
【题目】25 ℃时,将0.10mol/L的NaOH溶液逐滴滴入20 mL 0.10 mol/LCH3COOH溶液中,pH随滴入NaOH溶液体积的变化如下图所示。

(1)点①存在的电离平衡是___________。
(2)点②两溶液发生反应的离子方程式是_______。
(3)点③溶液的pH_____7(填“>”、“<”或“=”),此时c(Na+)_____c(CH3COO-)(填“>”、“<”或“=”)。
【答案】CH3COOH![]() CH3COO- + H+ CH3COOH+OH-=CH3COO-+H2O > >
CH3COO- + H+ CH3COOH+OH-=CH3COO-+H2O > >
【解析】
(1)点①是0.10mol/L CH3COOH溶液,CH3COOH是弱电解质,不完全电离,在溶液中醋酸分子电离产生醋酸根离子和氢离子,醋酸根离子和氢离子也会重新结合为醋酸分子,当达到电离平衡时,各种微粒的浓度不变,则点①存在的电离平衡是:CH3COOH![]() CH3COO- + H+;
CH3COO- + H+;
(2)点②为加入10mL 0.10mol/L的NaOH溶液,两溶液发生酸碱中和反应,则反应方程式为:CH3COOH+OH-=CH3COO-+H2O;
(3)点③为加入20mL 0.10mol/L的NaOH溶液,恰好生成CH3COONa,CH3COONa是强碱弱酸盐,在溶液中CH3COO-发生水解反应,消耗水电离产生的H+,当最终达到电离平衡时,溶液中c(OH-)>c(H+),使溶液呈碱性,则溶液pH>7,CH3COO-发生水解反应浓度减少,而Na+不水解,则溶液中c(Na+)>c(CH3COO-)。


科目:高中化学 来源: 题型:
【题目】物质在水中可能存在电离平衡、盐的水解平衡和沉淀溶解平衡。根据所学知识回答下列问题:
(1)下列方法中可以使0.1mol/L CH3COOH溶液中c(H+)/c(CH3COOH)值增大的措施是_____
A.加水稀释 B.加入少量CH3COONa 固体
C.加入少量冰醋酸气体 D.通入少量HCl
(2)t℃时,水的离子积常数KW=1×10-12。
①该温度下,若100体积pH=a的H2SO4溶液与1体积pH=b的NaOH溶液等体积混合后溶液呈中性,则a+b=___________。
②该温度下,pH=2的某酸HA溶液和pH=10的NaOH溶液等体积混合后,混合溶液的pH=5。试分析其原因:_______________________________;该混合溶液中:c(A-)-c(Na+)= ________________mol/L(填准确数值)
(3)常温下,有浓度均为0.1mol/L的三种溶液:a.NaHCO3 b.NaClO c.CH3COONa
①三种溶液pH由大到小的顺序为:_______________(填序号)
②溶液a的pH大于8,则溶液中c(H2CO3)___ c(CO32―)(填“>” “<”或“=”)
(4)已知25℃时,Ksp(AgCl)= 1.8×10-10,现将足量氯化银分别放入:
a.100mL 蒸馏水中 b.100mL 0.2mol/L AgNO3 溶液中
c.100mL 0.1mol/L氯化铝溶液中 d.100mL 0.1mol/L盐酸溶液中
充分搅拌后,相同温度下银离子浓度由大到小的顺序是______________(填序号);b中氯离子浓度为_____________mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学在日常生活和生产中有着重要的应用。下列说法不正确的是( )
A. 明矾水解形成的Al(OH)3胶体能吸附水中悬浮物,可用于水的净化
B. 某雨水样品采集后放置一段时间,pH由4.68变为4.28,是因为溶液中的SO32-水解
C. 将饱和FeCl3溶液滴入沸水中可制备Fe(OH)3胶体,利用的是盐类水解原理
D. 配制FeCl3溶液时加入少量的盐酸,抑制Fe3+水解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关的计算分析不正确的是( )
A. 在反应3Cu+8HNO3(稀)===3Cu(NO3)2+2NO↑+4H2O中,当有1 mol铜被氧化时,被还原的硝酸为2/3mol
B. 某溶液100 mL,其中含硫酸0.03 mol,硝酸0.04 mol,若在该溶液中投入1.92 g铜粉微热,反应后放出一氧化氮气体约为0.015 mol
C. 室温时,在容积为a mL的试管中充满NO2气体,然后倒置在水中到管内水面不再上升时为止;再通入b mL O2,则管内液面又继续上升,测得试管内最后剩余气体为c mL,且该气体不能支持燃烧。则a、b的关系为a=4b+3c
D. 物质的量之比为2∶5的锌与稀硝酸反应,若硝酸被还原的产物为N2O,反应结束后锌没有剩余,则该反应中被还原的硝酸与未被还原的硝酸的物质的量之比为1∶4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有常温条件下甲、乙、丙三种溶液,甲为0.1 mol/L的NaOH溶液,乙为0.1 mol/L的HCl溶液,丙为0.1 mol/L的CH3COOH溶液,试回答下列问题:
(1)甲溶液的pH=__________;
(2)丙溶液中存在电离平衡为_____________、______________(用电离方程式表示);
(3)某同学用甲溶液分别滴定20.00 mL乙溶液和 20.00 mL丙溶液,得到如图所示两条滴定曲线,请完成有关问题:
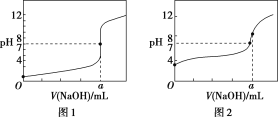
①甲溶液滴定丙溶液的曲线是________(填“图1”或“图2”);
②a=________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生用0.2000 mol·L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作可分为如下几步:
①用蒸馏水洗涤碱式滴定管,并注入NaOH溶液至“0”刻度线以上
②固定好滴定管并使滴定管尖嘴充满液体
③调节液面至“0”或“0”刻度线稍下,并记下读数
④量取20.00mL待测液注入洁净的锥形瓶中,并加入3mL酚酞溶液
⑤用标准液滴定至终点,记下滴定管液面读数

(1)以上步骤有错误的是(填编号)________。
(2)用标准NaOH溶液滴定时,应将标准NaOH溶液注入____中。(从图中选填“甲”或“乙”)
(3)下列操作会引起实验结果偏大的是:______(填编号)
A.在锥形瓶装液前,留有少量蒸馏水
B.滴定前,滴定管尖嘴有气泡,滴定后无气泡
C.量取待测液的滴定管用蒸馏水洗涤后,未用待测液润洗
D.装标准溶液的滴定管滴定前仰视读数,滴定后俯视读
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中正确的是( )
A. 摩尔是国际单位制中七个基本物理量之一
B. 铁的摩尔质量就是铁原子的相对原子质量
C. 含有NA个氧原子的硫酸的物质的量是0.25mol
D. 40gNaOH溶于1L水,溶质的物质的量浓度为1mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述在确的是
A. 等质量的CO与N2,质子数之比为1︰1
B. 标况下,相同体积的H2O和NH3含有的电子数相同
C. 1molO2分别与足量S、SO2反应,转移的电子数相同
D. 2 mol/L NH4CI溶液与1mol/L(NH4)2SO4溶液中,NH4+数目相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于化学反应与能量的说法不正确的是
A.乙醇的燃烧是放热反应
B.Mg与盐酸的反应是吸热反应
C.反应物化学键的断裂要吸收能量
D.化学反应伴随有能量的变化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com