
| 物质 | Al | Al2O3 | Fe | Fe2O3 |
| 熔点/℃ | 660 | 2054 | 1535 | 1565[ |
| 沸点/℃ | 2467 | 2980 | 2750 | ┄ |


 新题型全程检测期末冲刺100分系列答案
新题型全程检测期末冲刺100分系列答案科目:高中化学 来源:不详 题型:单选题
| A | B | C | D |
| NaAlO2溶液中逐滴滴加盐酸至过量 | AlCl3溶液中逐滴滴加氨水至过量 | 明矾溶液中逐滴滴加Ba(OH)2溶液至过量 | 澄清石灰水中缓慢通入CO2至过量 |
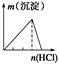 |  | 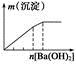 |  |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.分解反应 | B.化合反应 |
| C.置换反应 | D.复分解反应 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.实验室从海带提取单质碘的方法是:取样→灼烧→溶解→过滤→萃取 |
| B.用乙醇和浓H2SO4制备乙烯时,可用水浴加热控制反应的温度 |
| C.氯离子存在时,铝表面的氧化膜易被破坏,因此含盐腌制品不宜直接存放在铝制容器中 |
| D.将(NH4)2SO4、CuSO4溶液分别加入蛋白质溶液,都出现沉淀,表明二者均可使蛋白质变性 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
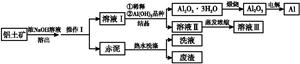
 2NaAlO2(aq)+4H2O,[Al2O3·3H2O也可表示为2Al(OH)3]
2NaAlO2(aq)+4H2O,[Al2O3·3H2O也可表示为2Al(OH)3]查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
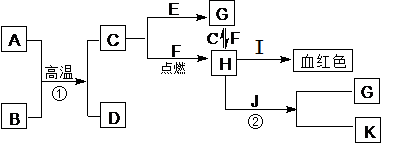
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
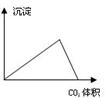
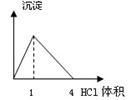
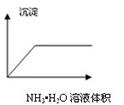

| A.在澄清石灰水中通入CO2气体至过量 |
| B.在NaAlO2溶液中逐滴加入HCl溶液至过量 |
| C.在AlCl3溶液中逐滴加入氨水至过量 |
| D.在AlCl3溶液中逐滴加入NaOH溶液至过量 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com