
【题目】某课外活动小组的同学在学习了电化学相关知识后,用如图装置进行实验,请回答下列问题:
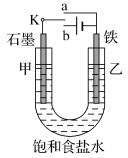
(1)实验一:将开关K与a连接,则乙电极上的反应式为___________________________________。
(2)实验一结束后,该研究小组的同学决定在乙电极表面上镀金属锌以防止铁被腐蚀,这种金属保护的原理名称是______________________。
(3)实验二:开关K与b连接,则甲为________极(填“正”“负”“阳”或“阴”);
(4)对于实验二,下列说法正确的是________(填字母编号)。
A.溶液中Na+向甲极移动
B.从甲极处逸出的气体能使湿润的淀粉-KI试纸变蓝
C.反应一段时间后加适量盐酸可恢复到电解前电解质的浓度
(5)当乙电极产生标准状况下224 mL气体,若剩余溶液体积为200 mL,则电解后所得溶液在常温下的pH为________。
【答案】Fe - 2e- = Fe2+ 牺牲阳极的阴极保护法 阳 B 13
【解析】
(1)判断铁为负极,再书写电极反应式。
(2)在乙电极表面上镀金属锌以防止铁被腐蚀,锌作负极,铁作正极,即可得到结论。
(3)与电源正极相连的即为阳极。
(4)“异性相吸”即阳离子向阴极移;甲极处逸出的气体为氯气,氯气能使湿润的淀粉-KI试纸变蓝;阳极得到氯气,阴极得到氢气,因此反应一段时间后加适量HCl可恢复到电解前电解质的浓度。
(5)根据方程式比例关系得到氢氧根物质的量,再得到浓度,再得pH。
(1)实验一:将开关K与a连接,则为吸氧腐蚀,乙为负极,其电极上的反应式为Fe - 2e- = Fe2+,故答案为:Fe - 2e- = Fe2+。
(2)实验一结束后,该研究小组的同学决定在乙电极表面上镀金属锌以防止铁被腐蚀,锌作负极,铁作正极,这种金属保护的原理名称是牺牲阳极的阴极保护法,
(3)实验二:开关K与b连接,与电源正极相连的即为阳极,故答案为阳。
(4)A选项,“异性相吸”即溶液中Na+向阴极即乙极移动,故A错误;
B选项,从甲极处逸出的气体为氯气,氯气能使湿润的淀粉-KI试纸变蓝,故B正确;
C选项,阳极得到氯气,阴极得到氢气,因此反应一段时间后加适量HCl可恢复到电解前电解质的浓度,故C错误。
综上所述,答案为B。
(5)当乙电极产生氢气,在标准状况下224 mL气体,即0.224L,若剩余溶液体积为200 mL,
H2 —— 2OH-
22.4L 2mol
0.224L xmol
22.4L:0.224L = 2mol:xmol
解得x = 0.02mol
![]() ,则pH = 13,故答案为13。
,则pH = 13,故答案为13。


 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案科目:高中化学 来源: 题型:
【题目】常温下,将除去表面氧化膜的Al、Cu片插入浓HNO3中组成原电池(如图1),测得原电池的电流强度(I)随时间(t)的变化如图2所示,已知0-t1时,原电池的负极是Al片,反应过程中有红棕色气体产生。下列说法不正确的是
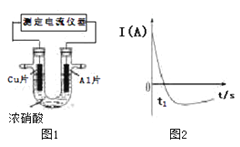
A. 0-t1时,正极的电极反应式为:2H++ NO3- - e-=NO2+ H2O
B. 0-t1时,溶液中的H+ 向Cu电极移动
C. t1时,负极的电极反应式为:Cu–2e-= Cu2+
D. t1时,原电池中电子流动方向发生改变是因为Al在浓硝酸中钝化,氧化膜阻碍了Al的进一步反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,用0.1molL-1Na2S溶液分别滴定10mL0.1molL-1CuCl2溶液以及10mL0.1molL-1ZnCl2溶液,溶液中-lgc(M2+)(M2+代表Zn2+或Cu2+)与Na2S溶液体积(V)的关系如图所示, b、c分别为滴定终点。下列有关说法错误的是[已知相同温度下:Ksp(CuS)<Ksp(ZnS)]( )
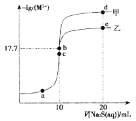
A.a点溶液中Cu2+、Zn2+的浓度相等
B.b、d两点中,水的电离程度d点大
C.曲线乙代表Na2S溶液滴定CuCl2溶液
D.可用ZnS固体除去ZnCl2溶液中的少量Cu2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用脆硫铅锑矿(主要成分为Pb4FeSb6S14)制取锑白(Sb2O3)的湿法冶炼工艺流程如下图所示。

已知:①锑(Sb)为ⅤA族元素,Sb2O3为两性氧化物;
②“水解”时锑元素转化为SbOCl沉淀;
③Ksp[Fe(OH)2]=8.0×10-16 mol3·L-3,Ksp[Fe(OH)3]=4.0×10-38mol4·L-4
回答下列问题:
(1)“氯化浸出”后的滤液中含有两种锑的氯化物,分别为SbCl3和___________(填化学式)。滤渣ⅰ中所含的反应产物有PbCl2和一种单质,该单质是___________。
(2)“还原”是用锑粉还原高价金属离子。其中,Sb将Fe3+转化为Fe2+的离子方程式为__________,该转化有利于“水解”时锑铁分离,理由是_________。
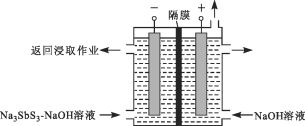
(3)“还原”用的Sb可由以下方法制得:用Na2S—NaOH溶液浸取辉锑精矿(Sb2S3),将其转化为Na3SbS3(硫代亚锑酸钠)—NaOH溶液。按下图所示装置电解后,阴极上得到Sb,阴极区溶液重新返回浸取作业,阴极的电极反应式为______。该装置中,隔膜是________(填“阳”或“阴”)离子交换膜。
(4)“中和”时若用NaOH溶液代替氨水,Sb2O3可能会转化为____________(填离子符号),使锑白的产量降低。
(5)锑白也可用火法冶炼脆硫铅锑矿制取,该法中有焙烧、烧结、还原和吹炼等生产环节。与火法冶炼相比,湿法冶炼的优点有____________(任写一点)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图所示各物质是由1~20号元素中部分元素组成的单质或化合物,图中部分反应条件未列出。已知D、L、M为气体单质,C、E、H为气体化合物,反应②、④、⑥是化工生产中的重要反应,反应⑤是实验室制备气体C的重要方法。
请回答下列问题:
(1)物质E的结构式为 __________。
(2)属于化合反应,但不属于氧化还原反应的是__________(用编号填空)。
(3)C、H的熔沸点比较:C___H(填““>”、“<”或“=”))原因是:________________。
(4)物质A由三种元素组成,1molA与水反应可生成1molB和2molC,A的化学式为
______________。
(5)在一定温度下,有甲、乙两容积相等的密闭容器。
I.向甲容器中通入3 mol M和4 mol L,反应达到平衡时,生成C的物质的量为a mol。此时,M的转化率为__________。下列能提高反应物L的转化率,但实际生产过程中并没有采用的措施是_____________。
①降低合成塔温度 ②适当增大压强
③不断分离出产物C ④加入合适催化剂
II.向乙中通入2 mol C,欲使反应达到平衡时,各物质的浓度与I中第一次平衡时相同,则起始时还需通入__________mol M和__________mol L。
III.若起始时,向乙中通入6mol M和8mol L,达到平衡时,生成C的物质的量为b mol,
则![]() ________
________![]() (选填“>”、“<”或“=”)。
(选填“>”、“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将15.6gNa2O2和5.4gAl同时放入一定量的水中,充分反应后得到200mL溶液,再缓慢通入HCl气体6.72L(标准状况),若反应过程中溶液的体积保持不变,则下列说法正确的是( )
A.反应过程中得到6.72L的气体(标准状况)
B.最终得到的溶液中溶质为NaCl和NaOH
C.最终得到7.8g的沉淀
D.最终得到的溶液中NaCl的物质的量浓度为1.5mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图装置中,U形管内为红墨水,a、b试管内分别盛有食盐水和稀盐酸,各加入生铁块,放置一段时间。下列有关描述错误的是( )

A.生铁块中的碳是原电池的正极
B.红墨水柱两边的液面变为左低右高
C.两试管中相同的电极反应式是:![]()
D.a试管中发生了吸氧腐蚀,b试管中发生了析氢腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用难溶于水的碳酸锶(SrCO3)粉末为原料(含少量钡和铁的化合物)制备高纯六水氯化锶晶体(SrCl2·6H2O),其过程为:
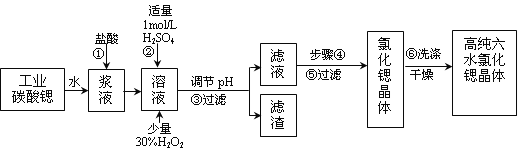
已知:Ⅰ.有关氢氧化物沉淀的pH:
氢氧化物 | Fe(OH)3 | Fe(OH)2 |
开始沉淀的pH | 1.5 | 6.5 |
沉淀完全的pH | 3.7 | 9.7 |
Ⅱ.SrCl2·6H2O晶体在61℃时开始失去结晶水,100℃时失去全部结晶水。
(1)操作①需要加快反应速率,措施有充分搅拌和____________________(写一种)。碳酸锶与盐酸反应的离子方程式________________________________。
(2)在步骤②~③的过程中,将溶液的pH值由1调节至_______;宜用的试剂为_______。
A.1.5 B.3.7 C.9.7 D.氨水 E.氢氧化锶粉末 F.碳酸钠晶体
(3)操作③中所得滤渣的主要成分是_______________________(填化学式)。
(4)工业上用热风吹干六水氯化锶,适宜的温度是_______。
A.50~60℃ B.80~100℃ C.100℃以上
(5)步骤⑥宜选用的无机洗涤剂是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】药物中间体M的合成路线流程图如图:

已知:

 (R、R’、R”为H或烃基)
(R、R’、R”为H或烃基)
请回答下列问题:
(1)A为芳香烃,名称为___。
(2)化合物C含有的官能团名称为__。
(3)下列说法中正确的是__。
A.化合物A只有1种结构可以证明苯环不是单双键交替的结构
B.可利用酸性KMnO4溶液实现A→B的转化
C.化合物C具有弱碱性
D.步骤④、⑤、⑥所属的有机反应类型各不相同
(4)步骤⑥可得到一种与G分子式相同的有机副产物,其结构简式是__。
(5)有机物H与氢气加成的产物J存在多种同分异构体。写出一种同时符合下列条件的同分异构体的结构简式__。
①能与FeCl3溶液发生显色反应;
②核磁共振氢谱检测表明分子中有4种化学环境不同的氢原子。
(6)写出I+G→M的化学方程式(可用字母G和M分别代替物质G和M的结构简式)__。
(7)设计以![]() 和CH3CH2OH为原料制备
和CH3CH2OH为原料制备![]() 的合成路线流程图_____(无机试剂任选)。
的合成路线流程图_____(无机试剂任选)。
合成路线流程图示例如下:CH2=CH2![]() CH3CH2Br
CH3CH2Br![]() CH3CH2OH
CH3CH2OH
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com