
����Ŀ��ҩ���м���M�ĺϳ�·������ͼ��ͼ��

��֪��

 ��R��R����R��ΪH��������
��R��R����R��ΪH��������
��ش��������⣺
(1)AΪ������������Ϊ___��
(2)������C���еĹ���������Ϊ__��
(3)����˵������ȷ����__��
A.������Aֻ��1�ֽṹ����֤���������ǵ�˫������Ľṹ
B.����������KMnO4��Һʵ��A��B��ת��
C.������C����������
D.����ܡ��ݡ����������л���Ӧ��������ͬ
(4)����ɵõ�һ����G����ʽ��ͬ���л��������ṹ��ʽ��__��
(5)�л���H�������ӳɵIJ���J���ڶ���ͬ���칹�塣д��һ��ͬʱ��������������ͬ���칹��Ľṹ��ʽ__��
������FeCl3��Һ������ɫ��Ӧ��
�ں˴Ź�������������������4�ֻ�ѧ������ͬ����ԭ�ӡ�
(6)д��I+G��M�Ļ�ѧ����ʽ��������ĸG��M�ֱ��������G��M�Ľṹ��ʽ��__��
(7)�����![]() ��CH3CH2OHΪԭ���Ʊ�
��CH3CH2OHΪԭ���Ʊ�![]() �ĺϳ�·������ͼ_____(���Լ���ѡ)��
�ĺϳ�·������ͼ_____(���Լ���ѡ)��
�ϳ�·������ͼʾ�����£�CH2=CH2![]() CH3CH2Br
CH3CH2Br![]() CH3CH2OH
CH3CH2OH
���𰸡��ڶ��ױ� �ǻ������� ABCD 
![]()
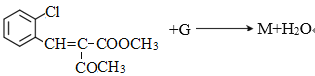

��������
��D�Ľṹ��A�ķ���ʽ����ȷ��AΪ![]() ��BΪ
��BΪ![]() ������G����E��
������G����E��![]() ���Ƴ�FΪ
���Ƴ�FΪ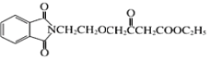 ,IΪ
,IΪ ��
��
(1)��A�Ľṹ��ʽ![]() ���ɵó�������Ϊ�ڶ��ױ�����Ϊ���ڶ��ױ���
���ɵó�������Ϊ�ڶ��ױ�����Ϊ���ڶ��ױ���
(2)���ݻ�����C�Ľṹ��ʽ����ȷ�����еĹ���������Ϊ�ǻ�����������Ϊ���ǻ���������
(3)A.�ڶ��ױ�ֻ��һ�ֽṹ������֤���������ǵ�˫�����棬A��ȷ��
B.����KMnO4��Һ�ɽ��ڶ��ױ�����Ϊ�ڱ������ᣬB��ȷ��
C.������C�����к��а��������������ԣ�C��ȷ��
D.����ܡ��ݡ��������ķ�Ӧ���ͷֱ�Ϊ����ȡ�����ӳɡ���ȥ��D��ȷ����Ϊ��ABCD��
(4)������У�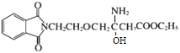 ��ˮʱ����ȥ�ǻ��ұߵ���ԭ�ӵ�G����ȥ��ߵ���ԭ�ӣ�����л��������ṹ��ʽ��
��ˮʱ����ȥ�ǻ��ұߵ���ԭ�ӵ�G����ȥ��ߵ���ԭ�ӣ�����л��������ṹ��ʽ��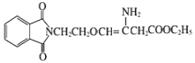 ����Ϊ��
������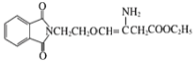 ��
��
(5)�л���H�������ӳɵIJ���JΪ![]() ��ͬʱ����������������FeCl3��Һ������ɫ��Ӧ���ں˴Ź�������������������4�ֻ�ѧ������ͬ����ԭ�ӡ���ͬ���칹�壬���б����ṹ�����ǻ������ǵ���ԭ����4�֣�ֻ���ڶ�λ������-CH2Cl�����ǵó��ṹ��ʽΪ
��ͬʱ����������������FeCl3��Һ������ɫ��Ӧ���ں˴Ź�������������������4�ֻ�ѧ������ͬ����ԭ�ӡ���ͬ���칹�壬���б����ṹ�����ǻ������ǵ���ԭ����4�֣�ֻ���ڶ�λ������-CH2Cl�����ǵó��ṹ��ʽΪ![]() ����Ϊ��
������![]() ��
��
(6) I+G��M�Ļ�ѧ����ʽΪ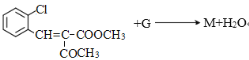 ����Ϊ��
������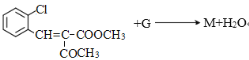 ��
��
(7)��![]() ��CH3CH2OHΪԭ���Ʊ�
��CH3CH2OHΪԭ���Ʊ�![]() ʱ����������Ϣ
ʱ����������Ϣ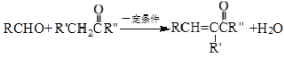 �����Ҵ�����Ϊ��ȩ��������Ϊ���ᣬ������������������������뱽��ȩ������Ϣ���ṩ�ķ�Ӧ���Ӷ����Ŀ���л���ϳ�·��Ϊ
�����Ҵ�����Ϊ��ȩ��������Ϊ���ᣬ������������������������뱽��ȩ������Ϣ���ṩ�ķ�Ӧ���Ӷ����Ŀ���л���ϳ�·��Ϊ![]() ����Ϊ��
������![]() ��
��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij����С���ͬѧ��ѧϰ�˵绯ѧ���֪ʶ������ͼװ�ý���ʵ�飬��ش��������⣺
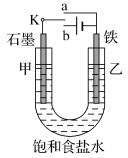
(1)ʵ��һ��������K��a���ӣ����ҵ缫�ϵķ�ӦʽΪ___________________________________��
(2)ʵ��һ�������о�С���ͬѧ�������ҵ缫�����϶ƽ���п�Է�ֹ������ʴ�����ֽ���������ԭ��������______________________��
(3)ʵ���������K��b���ӣ����Ϊ________��(�����������������������)��
(4)����ʵ���������˵����ȷ����________(����ĸ���)��
A����Һ��Na������ƶ�
B���Ӽ����ݳ���������ʹʪ��ĵ��ۣ�KI��ֽ����
C����Ӧһ��ʱ������������ɻָ������ǰ����ʵ�Ũ��
(5)���ҵ缫������״����224 mL���壬��ʣ����Һ���Ϊ200 mL�������������Һ�ڳ����µ�pHΪ________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Mg��Cu��ɵ�2.64 g�����Ͷ�뵽100 mLϡ��������ȫ�ܽ⣬���ռ���ԭ����NO���壨��ԭ����ֻ��һ�֣���Ȼ����Ӧ�����Һ����μ���2 mol��L-1NaOH��Һ����ͼ�����ɳ��������������NaOH��Һ�����Ĺ�ϵͼ������˵������ȷ����( )

A. ϡ�����Ũ��Ϊ1.9 mol/L
B. ���ɵ�NO�ڱ���µ����Ϊ0.896 L
C. a��ֵΪ15
D. Cu�����ʵ���Ϊ0.02 mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��80��ʱ��1L �ܱ������г���0.20 mol N2O4��������ӦN2O4![]() 2NO2 ��H = + Q kJ��mol��1(Q��0)������������ݣ�
2NO2 ��H = + Q kJ��mol��1(Q��0)������������ݣ�
ʱ��/s | 0 | 20 | 40 | 60 | 80 | 100 |
c(NO2)/mol��L��1 | 0.00 | 0.12 | 0.20 | 0.26 | 0.30 | 0.30 |
�����ж���ȷ����
A. �����¶ȸ÷�Ӧ��ƽ�ⳣ��K��С
B. 20��40s �ڣ�v(N2O4)= 0.004 mol��L��1��s��1
C. 100sʱ��ͨ��0.40 mol N2O4������ƽ��ʱN2O4��ת��������
D. ��Ӧ��ƽ��ʱ�����յ�����Ϊ0.15Q kJ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊ�ⶨ����ѪҺ��Ca2���ĺ�������������·�����
![]()
�йط�Ӧ�Ļ�ѧ����ʽΪ��2KMnO4+5H2C2O4+3H2SO4 K2SO4+2MnSO4+10CO2��+8H2O��ѪҺ��ƷΪ15mL���ζ����ɵIJ���������0.001mol��L��1��KMnO4��Һ15.0mL��������ѪҺ��Ʒ�еĺ�����Ϊ
A.0.001mol��L��1B.0.0025mol��L��1 C.0.0003mol��L��1D.0.0035mol��L��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ڳ�ʼ�¶�Ϊ500�桢�ݻ��㶨Ϊ10L�������ܱ������У���ͼ���Ϸ�����Ӧ��CO2 (g) +3H2 (g) ![]() CH30H(g)ʮH2 O (g)��H= -25kJ��mol����֪�Ҵﵽƽ��ʱ�����ѹǿΪ��ʼʱ��0��55�����ҡ����г�ʼ��Ӧ����ͬ��ƽ����Ӧ����ֵ����������ȡ����з�����ȷ����
CH30H(g)ʮH2 O (g)��H= -25kJ��mol����֪�Ҵﵽƽ��ʱ�����ѹǿΪ��ʼʱ��0��55�����ҡ����г�ʼ��Ӧ����ͬ��ƽ����Ӧ����ֵ����������ȡ����з�����ȷ����

A. �տ�ʼ��Ӧʱ���ʣ���>��
B. ƽ���Ӧ���ȣ���>��
C. 500���¸÷�Ӧƽ�ⳣ����K =3��102
D. ��a��0����0.9<b<l
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£�һ�����![]() �Ķ�Ԫ����
�Ķ�Ԫ����![]() ��Һ��һ�����
��Һ��һ�����![]() ��NaOH��Һ��Ϻ���Һ�����ԣ������ж���ȷ����
��NaOH��Һ��Ϻ���Һ�����ԣ������ж���ȷ����![]()
A.��Һ��![]()
B.��Һ��![]()
C.��Һ��![]()
D.��Һ��![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��50 mL 0.50 mol��L��1������50 mL 0.55 mol��L��1 NaOH��Һ����ͼ��ʾ��װ���н����кͷ�Ӧ��ͨ���ⶨ��Ӧ���������ų��������ɼ����к��ȡ��ش��������⣺

(1)��ʵ��װ���Ͽ���ͼ����ȱ�ٵ�һ�ֲ���������________��
(2)�ձ���������ֽ����������________��
(3)���ձ����粻��Ӳֽ�壬��õ��к�����ֵ____________(����ƫ��������ƫС��������Ӱ����)��
(4)��ʵ�鳣��0.50 mol��L��1 HCl��0.55 mol��L��1 NaOH��Һ��50 mL����ʵ�飬����NaOH��ҺŨ�ȴ�������Ũ�ȵ�������______�������µ���10 ��ʱ����ʵ�飬��ʵ��������ɽϴ������ԭ����_____________��
(5)ʵ���и���60 mL 0.50 mol��L��1������50 mL 0.50 mol��L��1 NaOH��Һ���з�Ӧ��������ʵ����ȣ�����õ��к���________(��������������������)���������ɣ� ______________��
(6)����ͬŨ�Ⱥ�����İ�ˮ����NaOH��Һ��������ʵ�飬��õ��к�����H��________(����ƫ��������ƫС��������Ӱ����)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ����0.1 mol��L-1 NaOH��Һ�ֱ�ζ�20 mLŨ�Ⱦ�Ϊ0.1 mol��L-1�IJ�ͬһԪ��ĵζ����ߣ�ͼ�������������������������ᡢ���ᡢ����ᡢ���ᣩ,����˵���������
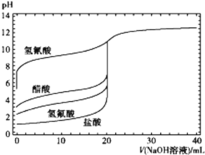
A.����:HF>CH3COOH>HCN
B.������10 mL NaOH��Һʱ,c(CN-)>c(CH3COO-)
C.��NaOH��Һ�ζ�����ʱ,Ӧ�÷�̪��ָʾ������ʹ�ü���
D.��NaOH��Һ����,CH3COOH��Һ��ˮ�ĵ���̶��ȱ����С
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com