
【题目】80℃时,1L 密闭容器中充入0.20 mol N2O4,发生反应N2O4![]() 2NO2 △H = + Q kJ·mol﹣1(Q>0),获得如下数据:
2NO2 △H = + Q kJ·mol﹣1(Q>0),获得如下数据:
时间/s | 0 | 20 | 40 | 60 | 80 | 100 |
c(NO2)/mol·L﹣1 | 0.00 | 0.12 | 0.20 | 0.26 | 0.30 | 0.30 |
下列判断正确的是
A. 升高温度该反应的平衡常数K减小
B. 20~40s 内,v(N2O4)= 0.004 mol·L-1·s-1
C. 100s时再通入0.40 mol N2O4,达新平衡时N2O4的转化率增大
D. 反应达平衡时,吸收的热量为0.15Q kJ
【答案】D
【解析】
A.正反应为吸热反应,升高温度平衡正向移动,平衡常数增大;
B.根据![]() 计算v(NO2),再利用速率之比等于其化学计量数之比计算v(N2O4);
计算v(NO2),再利用速率之比等于其化学计量数之比计算v(N2O4);
C. 100 s 时再通入0.40 mol N2O4,等效为在原平衡的基础上增大压强,与原平衡相比,平衡逆向移动;
D. 80s时到达平衡,生成二氧化氮为0.3 mol/L×1 L=0.3 mol,结合热化学方程式计算吸收的热量。
A. 该反应为吸热反应,温度升高,平衡向吸热的方向移动,即正反应方向移动,则颜色加深,A项错误;
B. 2040s内,![]() ,则
,则![]() ,B项错误;
,B项错误;
C.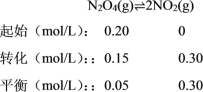
![]() =1.8,C项错误;
=1.8,C项错误;
D. 浓度不变时,说明反应已达平衡,反应达平衡时,生成NO2的物质的量为0.3 mol/L×1 L=0.3 mol,由热化学方程式可知生成2 molNO2吸收热量Q kJ,所以生成0.3 molNO2吸收热量0.15Q kJ,D项正确;
答案选D。


科目:高中化学 来源: 题型:
【题目】利用脆硫铅锑矿(主要成分为Pb4FeSb6S14)制取锑白(Sb2O3)的湿法冶炼工艺流程如下图所示。

已知:①锑(Sb)为ⅤA族元素,Sb2O3为两性氧化物;
②“水解”时锑元素转化为SbOCl沉淀;
③Ksp[Fe(OH)2]=8.0×10-16 mol3·L-3,Ksp[Fe(OH)3]=4.0×10-38mol4·L-4
回答下列问题:
(1)“氯化浸出”后的滤液中含有两种锑的氯化物,分别为SbCl3和___________(填化学式)。滤渣ⅰ中所含的反应产物有PbCl2和一种单质,该单质是___________。
(2)“还原”是用锑粉还原高价金属离子。其中,Sb将Fe3+转化为Fe2+的离子方程式为__________,该转化有利于“水解”时锑铁分离,理由是_________。
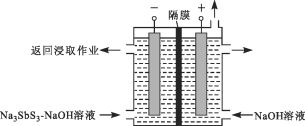
(3)“还原”用的Sb可由以下方法制得:用Na2S—NaOH溶液浸取辉锑精矿(Sb2S3),将其转化为Na3SbS3(硫代亚锑酸钠)—NaOH溶液。按下图所示装置电解后,阴极上得到Sb,阴极区溶液重新返回浸取作业,阴极的电极反应式为______。该装置中,隔膜是________(填“阳”或“阴”)离子交换膜。
(4)“中和”时若用NaOH溶液代替氨水,Sb2O3可能会转化为____________(填离子符号),使锑白的产量降低。
(5)锑白也可用火法冶炼脆硫铅锑矿制取,该法中有焙烧、烧结、还原和吹炼等生产环节。与火法冶炼相比,湿法冶炼的优点有____________(任写一点)。
查看答案和解析>>
科目:高中化学 来源: 题型:
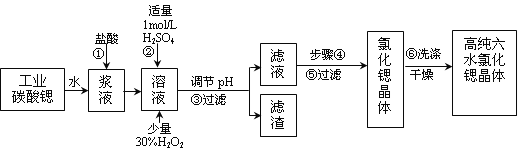
【题目】工业上用难溶于水的碳酸锶(SrCO3)粉末为原料(含少量钡和铁的化合物)制备高纯六水氯化锶晶体(SrCl2·6H2O),其过程为:
已知:Ⅰ.有关氢氧化物沉淀的pH:
氢氧化物 | Fe(OH)3 | Fe(OH)2 |
开始沉淀的pH | 1.5 | 6.5 |
沉淀完全的pH | 3.7 | 9.7 |
Ⅱ.SrCl2·6H2O晶体在61℃时开始失去结晶水,100℃时失去全部结晶水。
(1)操作①需要加快反应速率,措施有充分搅拌和____________________(写一种)。碳酸锶与盐酸反应的离子方程式________________________________。
(2)在步骤②~③的过程中,将溶液的pH值由1调节至_______;宜用的试剂为_______。
A.1.5 B.3.7 C.9.7 D.氨水 E.氢氧化锶粉末 F.碳酸钠晶体
(3)操作③中所得滤渣的主要成分是_______________________(填化学式)。
(4)工业上用热风吹干六水氯化锶,适宜的温度是_______。
A.50~60℃ B.80~100℃ C.100℃以上
(5)步骤⑥宜选用的无机洗涤剂是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车尾气(含烃类、CO、NO与SO2等),是城市主要污染源之一,治理的办法之一是在汽车排气管上装催化转化器,它使NO与CO反应生成可参与大气生态循环的无毒气体,反应原理:2NO(g)+2CO(g)= N2(g)+2CO2(g),在298 K、100 kPa下,ΔH=-113 kJ·mol-1、ΔS=-145 J·mol-1·K-1。下列说法中错误的是( )
A.该反应中反应物的总能量高于生成物的总能量
B.该反应常温下不能自发进行,因此需要高温和催化剂
C.该反应常温下能自发进行,高温和催化剂只是加快反应的速率
D.汽车尾气中的这两种气体会与血红蛋白结合而使人中毒
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示2套实验装置,分别回答下列问题。


(1)装置1中的Cu是_________极(填“正”或“负”),该装置发生的总反应的离子方程式为___________。
(2)装置2中甲烧杯盛放100 mL 0.2 mol/L的NaCl溶液,乙烧杯盛放100 mL 0.5 mol/L的CuSO4溶液。反应一段时间后,停止通电。向甲烧杯中滴入几滴酚酞,观察到右边石墨电极附近首先变红,左边石墨电极附近无明显现象。
① 电源的M端为_________极,甲烧杯右边石墨电极附近首先变红的原因是___________________。
② 乙烧杯中电解反应的离子方程式为____________。
③ 若装置甲阴、阳两极各产生112mL气体(标准状况),则装置乙所得溶液的pH为______(忽略反应前后溶液的体积变化)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸钙是一种用途非常广泛的产品,可用于生产硫酸、漂白粉等一系列物质(见下图)。下列说法正确的是

A.CO、SO2、SO3均是酸性氧化物
B.工业上利用Cl2和澄清石灰水反应来制取漂白粉
C.除去与水反应,图示转化反应均为氧化还原反应
D.用CO合成CH3OH进而合成HCHO的两步反应,原子利用率均为100%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】药物中间体M的合成路线流程图如图:

已知:

 (R、R’、R”为H或烃基)
(R、R’、R”为H或烃基)
请回答下列问题:
(1)A为芳香烃,名称为___。
(2)化合物C含有的官能团名称为__。
(3)下列说法中正确的是__。
A.化合物A只有1种结构可以证明苯环不是单双键交替的结构
B.可利用酸性KMnO4溶液实现A→B的转化
C.化合物C具有弱碱性
D.步骤④、⑤、⑥所属的有机反应类型各不相同
(4)步骤⑥可得到一种与G分子式相同的有机副产物,其结构简式是__。
(5)有机物H与氢气加成的产物J存在多种同分异构体。写出一种同时符合下列条件的同分异构体的结构简式__。
①能与FeCl3溶液发生显色反应;
②核磁共振氢谱检测表明分子中有4种化学环境不同的氢原子。
(6)写出I+G→M的化学方程式(可用字母G和M分别代替物质G和M的结构简式)__。
(7)设计以![]() 和CH3CH2OH为原料制备
和CH3CH2OH为原料制备![]() 的合成路线流程图_____(无机试剂任选)。
的合成路线流程图_____(无机试剂任选)。
合成路线流程图示例如下:CH2=CH2![]() CH3CH2Br
CH3CH2Br![]() CH3CH2OH
CH3CH2OH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生想制作一种家用环保型消毒液发生器,用石墨作电极解饱和氯化钠溶液,通电时,为使Cl2被完成吸收投篮有较强杀菌能力的消毒液,设计了如图所示的装置,以下对电源电极名称和消毒液和主要成分判断正确的是( )
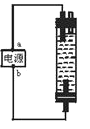
A.a为正极,b为负极:NaClO和NaCl
B.a为负极,b为正极:NaClO和NaCl
C.a为阳极,b为阴极:HClO和NaCl
D.a为阴极,b为阳极:HClO和NaCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在有机物的分子中,当碳原子连有4个不同的原子或原子团时,这种碳原子称为“手性碳原子”,在其旁边标有*号。凡具有一个手性碳原子的化合物一定具有光学活性。如图有机物含有一个手性碳原子,具有光学活性,当发生下列化学反应,生成的新有机物无光学活性的是( )
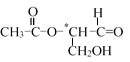
A.与氢氧化钠水溶液共热反应B.与新制银氨溶液共热反应
C.与甲酸在一定条件下发生酯化反应D.与H2发生加成反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com