
【题目】某无色稀溶液X中,可能含有如表所列离子中的某几种。
取该溶液适量,向其中加入某试剂Y,产生沉淀的物质的量(n)与加入试剂体积(y)的关系如图所示。下列说法正确的是
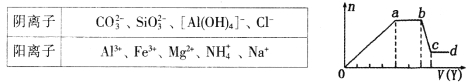
A.若Y是盐酸,则X中一定含有CO32-、SiO32-、[Al(OH)4]-和NH4+
B.若Y是NaOH溶液,则X中一定含有A13+、Fe3+、NH4+、Cl-
C.若Y是NaOH溶液,则ab段发生反应的离子方程式为:NH4++OH-=NH3↑+H2O
D.若Y是NaOH溶液,则X中的Al3+、Mg2+、NH4+物质的量之比为2:1:4
【答案】D
【解析】
试题分析:溶液无色说明溶液中不含Fe3+;(1)如果Y是盐酸,向溶液中加盐酸,先生成沉淀,则溶液中可能含SiO32﹣、AlO2﹣或两者中的一种,即生成的沉淀为H2SiO3、Al(OH)3或两者中的一种,则溶液中不含Al3+、Mg2+;当a﹣b段时,沉淀的量不变化,发生的是盐酸和碳酸根离子反应生成气体:CO32﹣+H+═HCO3﹣,HCO3﹣+H+═H2O+CO2↑;当b﹣c段时沉淀的质量减少,即部分沉淀和盐酸反应:Al(OH)3+3H+═Al3++3H2O,部分沉淀和盐酸不反应,说明生成的沉淀既有H2SiO3又有Al(OH)3,原溶液中有SiO32﹣和AlO2﹣,则oa段发生反应的离子方程式SiO32﹣+2H+═H2SiO3↓,AlO2﹣+H++H2O═Al(OH)3↓,由于SiO32﹣和AlO2﹣和铵根离子能双水解,所以溶液中不含NH4+,含有的阳离子是Na+.则X中一定含有的离子是CO32﹣、SiO32﹣、AlO2﹣、Na+,oa段发生反应的离子方程式SiO32﹣+2H+═H2SiO3↓,AlO2﹣+H++H2O═Al(OH)3↓,ab段发生反应的离子方程式CO32﹣+H+═HCO3﹣,HCO3﹣+H+═H2O+CO2↑,bc段发生反应的离子方程式:Al(OH)3+3H+═Al3++3H2O.综上可知含有的离子为:CO32﹣、SiO32﹣、AlO2﹣、Na+;
(2)若Y是氢氧化钠,向溶液中加氢氧化钠溶液,先生成沉淀,溶液中可能含Al3+、Mg2+或两者中的一种,由于弱碱阳离子和弱酸根会双水解而不能共存,即溶液中不含CO32﹣、SiO32﹣、AlO2﹣,由于溶液一定要保持电中性,故溶液中一定含Cl﹣;当a﹣b段时,沉淀的量不变化,是氢氧化钠和铵根离子反应生成气体:NH4++OH﹣═NH3H2O,即溶液中含NH4+;当b﹣c段时沉淀的质量减少但没有完全溶解,即部分沉淀和氢氧化钠反应,部分沉淀不反应,说明溶液中有Al3+、Mg2+,即bc段的反应为:Al(OH)3+OH﹣═AlO2﹣+2H2O.综上可知,X中一定含有的离子是Al3+、Mg2+、NH4+、Cl﹣;
A.由分析可知,若Y是盐酸,则X中一定含有:CO32﹣、SiO32﹣、AlO2﹣、Na+,故A错误;B.若Y是氢氧化钠,X中一定含有的离子是Al3+、Mg2+、NH4+、Cl﹣,没有Fe3+,故B错误;C.若Y是NaOH溶液,当a﹣b段时,沉淀的量不变化,是氢氧化钠和铵根离子反应生成气体:NH4++OH﹣═NH3H2O,故C错误;D.与铵根离子反应需要氢氧化钠的体积是2v,氢氧化铝和氢氧化钠反应需要氢氧化钠的体积是1v,则生成氢氧化铝需要氢氧化钠的体积是3V,生成氢氧化镁需要氢氧化钠的体积是1V,则n(Al3+):n(Mg2+):n(NH4+)=1:![]() :2=2:1:4,故D正确.故选D.
:2=2:1:4,故D正确.故选D.


科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数,下列说法正确的是( )
A. 22.4 L O2的质量约为32g
B. 17g NH3所含原子数为4NA,所含电子数为10NA
C. 标准状况下,22.4LH2O所含水分子为NA个
D. 0.5 mol/L Fe2(SO4)3 溶液中,SO42-的数目为1.5 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生产、生活密切相关,下列叙述正确的是
A.气象环境报告中新增的“PM2.5”是一种新的分子
B.光化学烟雾、硝酸型酸雨的形成均与氮氧化物有关
C.煤的干馏和液化均为物理变化
D.用活性炭为糖浆脱色和用次氯酸盐漂白纸浆的原理相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生产、生活息息相关,下列叙述错误的是( )
A.为防止电池中的重金属污染土壤和水体,应积极开发废旧电池的综合回收利用
B.氢能是清洁能源,工业上电解水法制大量氢气符合节能减排理念
C.大量的汽车尾气是造成雾霾天气的一个重要因素
D.煤的液化和气化均属于化学变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下是反应:2SO2+O2![]() 2SO3在不同条件下达到平衡状态时SO2的转化率。
2SO3在不同条件下达到平衡状态时SO2的转化率。
压强 转化率 温度 | 0.1MPa | 0.5MPa | 1MPa | 10MPa |
400℃ | 99.2% | 99.6% | 99.7% | 99.9% |
500℃ | 93.5% | 96.9% | 97.8% | 99.3% |
600℃ | 73.7% | 85.8% | 89.5% | 96.4% |
试回答下列问题。
(1)关于可逆反应的限度,你能得出什么启示?
________________________________________。
(2)提高该化学反应限度的途径有:_____________________。
(3)要实现SO2的转化率为93.5%,需控制的反应条件是____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数,下面叙述正确的是 ( )
A.标准状况下,11.2L SO3所含分子数为0.5 NA
B.1L 1mol/L的氯化钠溶液中,所含离子数为NA
C.常温下,4.4g CO2和N2O(不反应)混合物中所含有的原子数为0.3 NA
D.一定量的铜与足量的浓硫酸反应,放出2.24L气体时,转移电子数为0.2 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】.已知A、B、D、E均为中学化学中的常见物质,它们之间的转化关系如图所示(部分产物略去),则下列有关物质的推断不正确的是
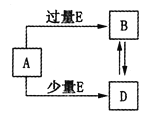
A.若A是铁,则E可能为稀硝酸
B.若A是CuO,E是碳,则B为CO
C.若A是AlCl3溶液,E可能是氨水
D.若A是NaOH溶液,E是CO2,则B为NaHCO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A.1 L水中溶解了40 g NaOH后,所得溶液浓度为1 mol/L
B.从1 L 2 mol/L的NaCl溶液中取出0.5 L,该溶液的浓度为1 mol/L
C.将2.24 L(标准状况)HCl气体溶于水制成100 mL溶液,其物质的量浓度为1 mol/L
D.配制1 L 0.2 mol/L的CuSO4溶液,需用32g胆矾
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com