
某温度下,体积一定的密闭容器中进行如下可逆反应X(g)+Y(g)  Z(g)+W(s) ΔH>0。下列叙述中,正确的是( )
Z(g)+W(s) ΔH>0。下列叙述中,正确的是( )
A.加入少量W,逆反应速率增大
B.当容器中气体压强不变时,反应达到平衡
C.升高温度,平衡逆向移动
D.改变条件,又达新平衡,此时上述反应的平衡常数K值一定增大
科目:高中化学 来源:2016-2017学年河南省许昌市五校高二上学期第一次联考化学试卷(解析版) 题型:选择题
下列关于某些离子的检验说法正确的是( )
A.向某溶液中加稀盐酸,将产生的无色气体通入澄清石灰水中,石灰水变浑浊, 则原溶液中一定有CO32﹣
B.向某溶液中加入硝酸钡溶液有白色沉淀产生,再加稀盐酸,沉淀不消失,则原溶液中可能含有SO32-
C.向某溶液中加入浓氢氧化钠溶液并加热,产生的气体能使湿润蓝色石蕊试纸变红,则原溶液中存在NH4+
D.分别含有Mg2+、Cu2+、Fe2+和Na+的四种盐溶液,只用NaOH溶液不能一次鉴别出来
查看答案和解析>>
科目:高中化学 来源:2016-2017学年辽宁省高二上期初考试化学卷(解析版) 题型:实验题
某校化学研究性学习小组的同学探究以铜为电极电解电解质溶液的情况,
第一组同学以铜为电极电解饱和食盐水,探究过程如下:
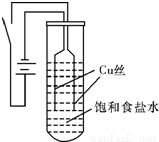
【实验Ⅰ】如图装置,电源接通后,与电池负极相连的铜丝上有大量气泡产生;与电池正极相连的铜丝由粗变细.电解开始30s内,阳极附近出现白色浑浊,然后开始出现橙黄色浑浊,此时测定溶液的pH约为10;随着沉淀量的逐渐增加,橙黄色沉淀慢慢聚集在试管底部,但溶液始终未出现蓝色。
【实验Ⅱ】将实验Ⅰ中试管底部的橙黄色沉淀取出,分装在两支小试管中,沉淀很快转变为砖红色,后续的操作及现象如下:

请回答下列问题:
(1)聚集在试管底部的橙黄色沉淀的化学式为______________.
(2)阳极的电极反应式为______________.
(3)写出实验Ⅱ中①、②的离子方程式:①__________;②__________.
(4)第二组同学将质量相等的铜片和铂片插入硫酸铜溶液中,铜片与电源正极相连铂片与电源负极相连,以电流强度1A通电10min,然后反接电源,以电流强度2A继续通电10min.画出下列表示铜电极、铂电极、电解池中产生气体的质量和电解时间的关系图,其中正确的是( )
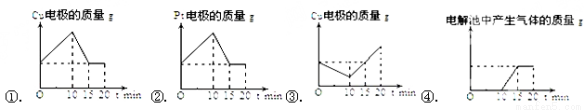
查看答案和解析>>
科目:高中化学 来源:2016-2017学年辽宁省高二上期初考试化学卷(解析版) 题型:选择题
在一个固定体积的密闭容器 中,向容器内充入2molA和1molB,发生如下反应:2A(g) + B(g) ? 3C(g) + D(s),反应达到平衡时C的物质的量浓度为1.2 mol/L.若维持容器的温度和体积不变,按下列方法改变起始物质,达到平衡时C的浓度仍为1.2 mol/L的是
A.4molA + 2molB B.3molC+ 1molD+ 1molB
C.3molC + 0.8molD D.1.6molA+0.8molB + 0.6molC+0.3molD
查看答案和解析>>
科目:高中化学 来源:2016-2017学年黑龙江省高二上开学测化学卷(解析版) 题型:填空题
甲醇被称为2l世纪的新型燃料,工业上通过下列反应①和②,用CH4和H2O为原料来制备甲醇。
① CH4(g)+H2O(g)  CO(g)+3H2(g) ΔH1
CO(g)+3H2(g) ΔH1
② CO(g)+2 H2(g)
H2(g)  CH3OH(g) ΔH2
CH3OH(g) ΔH2
将0.20mol CH4(g)和0.30 mol H2O(g)通入容积为10L的密闭容器中,在一定条件下发生反应①,达到平衡时,CH4的转化率与温度、压强的关系如图。
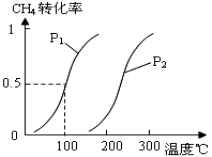
(1)温度不变,缩小体积,增大压强,①的反应速率 ______(填“增大”、“减小”或“不变”),平衡向 ___方向移动。
(2)温度升高,反应①的ΔH1 0(填“<”、“=”或“>”),其平衡常数表达式为K= ,100℃时的平衡常数值是 ______。
(3)在压强为0.1 MPa条件下, 将a mol CO与 3 a mol H2的混合气体在催化剂作用下进行反应②生成甲醇。为了寻找合成甲醇的温度和压强的适宜条件,某同学设计了三组实验,部分实验条件已经填在下面实验设计表中。请在下表空格中填入剩余的实验条件数据。
实验编号 | T(℃) | n (CO)/n(H2) | P(MPa) |
I | 150 | 1/3 | 0.1 |
II | 5 | ||
III | 350 | 5 |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年黑龙江省高二上开学测化学卷(解析版) 题型:选择题
(双选)向某密闭容器中加入0 .3 molA 、0 .1 molC 和一定量的 B 三种气体。一定条 件下发生反应,各物质浓度随时间变化如甲图所示[t0~ t1阶段 c ( B)未画出]。附图乙为 t2时刻后改变条件平衡体系中反应速率随时间变化的情况,且四个阶段都各改变一种不同的条件并且所用条件均不同。已知,t3~t4阶段为使用催化剂。下列说法正确的是 ( )
件下发生反应,各物质浓度随时间变化如甲图所示[t0~ t1阶段 c ( B)未画出]。附图乙为 t2时刻后改变条件平衡体系中反应速率随时间变化的情况,且四个阶段都各改变一种不同的条件并且所用条件均不同。已知,t3~t4阶段为使用催化剂。下列说法正确的是 ( )
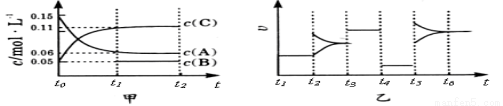
A.若t1=15 s,生成物C在t0~t1时间段的平均反应速率为0.004mol·L-1·s-1
B.t4~t5阶段改变的条件为降低反应温度
C.B的起始物质的量为 0.02mol
D.t5~t6阶段容器内A的物质的量减少0.03 mol,而此过程中容器与外界的热交换总量为akJ,该反应的热化学方程式为3A(g) B(g)+2C(g) ΔH=+100akJ·mol-1
B(g)+2C(g) ΔH=+100akJ·mol-1
查看答案和解析>>
科目:高中化学 来源:2016-2017学年黑龙江省高二上开学测化学卷(解析版) 题型:选择题
已知(1)H2O(g)==H2O(l)ΔH1=-Q1kJ·mol-1
(2)CH3OH(g)==CH3OH(l)△H2=-Q2kJ·mol-1
(3)2CH3OH(g)+3O2(g)==2CO2(g)+4H2O(g)△H3=-Q3kJ·mol-1(Q1、Q2、Q3均大于0)若要使32g液态甲醇完全燃烧,最后恢复到室温,放出的热量为(单位:kJ)( )
A. Q1+Q2+Q3 B.0.5 Q3-Q2+2Q1 C.0.5 Q3+ Q2-2Q1 D.0.5(Q1+Q2+Q3)
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北省高二上9.4周考化学卷(解析版) 题型:选择题
有①Na2C03溶液②CH3COONa溶液③NaOH溶液 ④CH3COONH4溶液各25mL, 物质的量浓度均为0.1mol/L,下列说法正确的是( )
A.四种溶液的pH大小顺序是③>②>①>④
B.若分别加入25mLO.1mol/L的盐酸充分反应后,pH最大的是①
C.若将四种溶液稀释相同倍数,pH 变化最大的是④
D.升高温度,四种溶液的pH均减小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com