
| A. | R一定是氧元素 | B. | R的最高价氧化物为RO2 | ||
| C. | R的气态氢化物很稳定 | D. | R可以形成多种含氧酸 |
分析 根据主族元素的最高正化合价+|最低负化合价|=8,主族元素的最高正化合价=最外层电子数,当主族元素R的最高正化合价与最低负化合价代数和为4时,即最高正价为+6价,原子最外层电子数为6,则R为第ⅥA族元素,结合元素周期表及元素化合物知识答题.
解答 解:根据主族元素的最高正化合价+|最低负化合价|=8,主族元素的最高正化合价=最外层电子数,当主族元素R的最高正化合价与最低负化合价代数和为4时,即最高正价为+6价,原子最外层电子数为6,则R为第ⅥA族元素,
A.O没有正化合价,故A错误;
B.R为第ⅥA族元素,最高价为+6价,最高价氧化物为RO3,故B错误;
C.如为非金属性较弱的元素,则对应的氢化物不稳定,如硫化氢,故C错误;
D.若R为S元素,可形成硫酸、亚硫酸等,故D正确.
故选D.
点评 本题主要考查了元素化合价与原子结构的关系,为高考常见题型,侧重学生的分析能力的考查,注意把握常见元素化合价,并在此基础上判断元素在周期表的位置及部分元素的性质等,难度不大.


 寒假乐园北京教育出版社系列答案
寒假乐园北京教育出版社系列答案科目:高中化学 来源: 题型:实验题
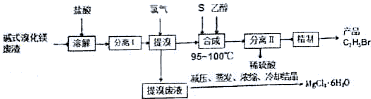
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | A、C两种元素仅可组成化学式为CA3的化合物 | |
| B. | F与D形成的化合物性质很不活泼,不与任何酸反应 | |
| C. | 原子半径由大到小的顺序是E>F>C>D | |
| D. | 元素的非金属性由强到弱的顺序是D>C>F>B |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{a}^{b}$R | B. | ${\;}_{a-2}^{a+b-2}$R | C. | ${\;}_{a+2}^{a+b+2}$R | D. | ${\;}_{a-2}^{a+b}$R |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 操作 | 现象 | 结论 |
| A | 将20mL2mol/L的NaOH溶液缓缓地倒入20mL2mol/L的盐酸中,边加边搅拌,测定反应前后溶液温度的变化 | 温度升高 | 释放出的热量就是中和热 |
| B | 常温下将Al片放入浓硝酸中 | 无明显变化 | Al与浓硝酸不反应 |
| C | 将一小段镁带和一小块铝分别放在同体积、同浓度的盐酸中 | 都有气泡产生,镁带产生气泡更快 | 镁比铝活泼 |
| D | 将少量氯气通入到NaBr溶液中 | 溶液变成橙红色 | 氯气溶于水呈现橙红色 |
| A. | A | B. | B | C. | C□D.D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 当a:b>2时,发生的离子反应为:2OH-+CO2═CO32-+H2O | |
| B. | 当a:b<1时,发生的离子反应为:OH-+CO2═HCO3- | |
| C. | 当2a=3b时,发生的离子反应为:2OH-+CO2═CO32-+H2O | |
| D. | 当0.5a<b<a时,溶液中HCO3-与CO32-共存 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X>Y>Z>W | B. | Y>X>W>Z | C. | Z>X>Y>W | D. | Z>Y>X>W |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com