
【题目】两份铝片,第一份与足量盐酸反应,第二份与足量烧碱溶液反应.同温同压下放出相同体积的气体,则两份铝片的质量之比为( )
A.1:1
B.2:3
C.3:2
D.1:6
科目:高中化学 来源: 题型:
【题目】下列事实与胶体性质无关的是( )
A.清晨,在茂密的树林,常常可以看到从枝叶间透过的一道道光柱
B.在豆浆里加入盐卤做豆腐
C.三氯化铁溶液中滴入氢氧化钠溶液出现红褐色沉淀
D.盐碱地里土壤保肥能力差
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于钠的叙述中,正确的是( )
A.钠是银白色金属,硬度很大
B.金属钠的熔点很高
C.做钠与水反应时,要用到的仪器有镊子、小刀、滤纸、烧杯、玻璃片
D.将金属钠放在石棉网上加热后,金属钠剧烈燃烧,产生黄色火焰,生成白色固体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】0.1molH2SO4的质量为_________g,配制成500mL溶液后,H2SO4的物质的量浓度为__________mol/L,其中SO42-的物质的量浓度为________mol/L,H+的物质的量浓度为_________mol/L,跟足量的锌完全反应生成的氢气在标准状况下所占的体积为_________L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,A是可用来对自来水进行消毒的黄绿色单质气体,A、B、C、D、E都含X元素,其转化关系如图所示。
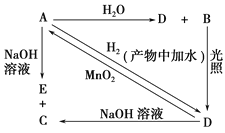
(1)请分别写出A、B、D的化学式(如为溶液请填溶质的化学式):A________、B________、D________;
(2)写出下列反应的化学方程式或离子方程式(请注明条件):
A+H2O(离子方程式):____________________;
A+NaOH(离子方程式):_____________________;
D→A(化学方程式):__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】相同条件下,等体积、等pH的醋酸溶液和盐酸分别加水稀释后,溶液的pH仍相同,则所得溶液的体积
A. 仍相同 B. 醋酸溶液的大 C. 盐酸的大 D. 无法判断
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.控制变量法是化学实验的一种常用方法。下表是某学习小组研究等物质的量浓度的稀硫酸和锌反应的实验数据,分析以下数据,回答下列问题:
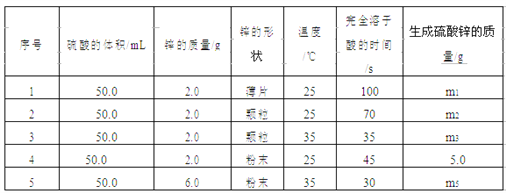
(1)本实验中实验 2 和实验 3 表明________对反应速率有影响。
(2)若采用与实验 1 完全相同的条件,但向反应容器中滴加少量硫酸铜溶液,发现反应速率明显加快。原因是______________________________。
Ⅱ.某温度时,在 5 L 的容器中,X、Y、Z 三种气体的物质的量随时间的变化曲线如图所示。请通过计算回答下列问题:
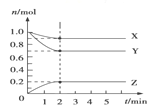
(3)反应开始至 2 min,Y 的平均反应速率_______mol/(L·min)。
(4)反应开始至 2 min,X 的转化率________。
(5)写出 X、Y、Z 的反应方程式________________。
Ⅲ.(6)C2H5OH-O2-KOH 溶液燃料电池,则负极电极反应式为________。反应进行后,溶液的 pH________(填“增大”、“减小”或“不变”)。
(7)将该反应 Fe+2FeCl3=3FeCl2 设计成原电池。则负极材料为_______,正极材料为______。正极反应式________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,反应H2(g)+I2(g)![]() 2HI(g)△H<0,在带有活塞的密闭容器中达到平衡,下列说法中不正确的是
2HI(g)△H<0,在带有活塞的密闭容器中达到平衡,下列说法中不正确的是
A. 容器体积不变,升温正、逆反应速率均增大
B. 温度、压强均不变,充入氦气,正、逆反应速率不变
C. 温度不变,压缩气体的体积,平衡不移动,颜色加深
D. 容积、温度不变,充入氦气后,正、逆反应速率不变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com