
【题目】下列反应中的能量变化与图示一致的是

A. 盐酸和NaOH溶液混合
B. CH4在空气中燃烧
C. 电解水得到H2和O2
D. Al与Fe2O3反应
 阶梯计算系列答案
阶梯计算系列答案科目:高中化学 来源: 题型:
【题目】如图是一种应用广泛的锂电池,LiPF6是电解质,SO(CH3)2是溶剂,电池反应为:4Li+FeS2=Fe+2Li2S。下列说法不正确的是
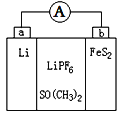
A. 该装置将化学能转化为电能
B. 可以用水代替 SO(CH3)2做溶剂
C. 电子移动方向是由a极经外电路流向b极
D. b极电极反应式是:FeS2+4Li++4e-=Fe+2Li2S
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】燃料电池能有效提高能源利用率,具有广泛的应用前景。下列物质均可用作燃料电池的燃料,其中最环保的是( )
A. 甲醇 B. 天然气 C. 液化石油气 D. 氢气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关溶液组成的描述合理的是( )
A. 在Fe2(SO4)3溶液中可以大量存在:K+、Fe2+、Cl-、Br-、SCN-
B. c(H+)=1×10-13mol/L的溶液中可以大量存在:Mg2+、Cu2+、![]() 、
、![]()
C. 加水稀释时![]() 值增大的溶液中可大量存在:
值增大的溶液中可大量存在: ![]() 、
、![]() 、
、![]() 、
、![]()
D. 在碱性溶液中可以大量存在: ![]() 、AlO2-、
、AlO2-、![]() 、
、![]() 、
、![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知K、Ka、Kw、Kh、Ksp分别表示化学平衡常数、弱酸的电离平衡常数、水的离子积常数、盐的水解平衡常数、难溶电解质的溶度积常数。
(1)25℃时,将a mol/L的氨水与0.01 mol/L的盐酸等体积混合所得溶液中,c(NH4+)=c(Cl-)则溶液显__________(填"酸""碱"或"中")性;用含a的代数式表示NH3·H2O的电离平衡常数Kb=__________;
(2)25℃,H2SO3![]() HSO3-+H+,其电离平衡常数Ka=1×10-2 mol/L,则该温度下pH=3,c(HSO3-)=0.1mol/L的NaHSO3溶液中c(H2SO3)=__________;
HSO3-+H+,其电离平衡常数Ka=1×10-2 mol/L,则该温度下pH=3,c(HSO3-)=0.1mol/L的NaHSO3溶液中c(H2SO3)=__________;
(3)高炉炼铁中发生的反应有:FeO(s)+CO(g)![]() Fe(s)+CO2(g) ΔH<0
Fe(s)+CO2(g) ΔH<0
①该反应的平衡常数表达式K=__________;
②已知1100℃时,K=0.25,则平衡时CO的转化率为__________;
③在该温度下,若测得高炉中c(CO2)=0.020mol/L,c(CO)=0.1 mol/L,则此时反应速率v正__________(填">""<"或"=")v逆
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用VSEPR模型预测下列分子或离子的立体结构,其中正确的是 ( )
A. H2O与BeCl2为角形(V形) B. CS2与SO2为直线形
C. SO3与CO![]() 为平面三角形 D. BF3与PCl3为三角锥形
为平面三角形 D. BF3与PCl3为三角锥形
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com