
【题目】下列属于强酸的是
A. H3PO4B. HFC. H2SO3D. HClO4
科目:高中化学 来源: 题型:
【题目】在一定温度下,10mL0.40mol/L H2O2发生催化分解。不同时刻测定生成O2的体积(已折算为标准状况)如下表。
t/min | 0 | 2 | 4 | 6 | 8 | 10 |
V(O2)/mL | 0.0 | 9.9 | 17.2 | 22.4 | 26.5 | 29.9 |
下列叙述不正确的是(溶液体积变化忽略不计)
A.0~6min的平均反应速率:v(H2O2)![]()
![]() mol/(L·min)
mol/(L·min)
B.6~10min的平均反应速率:v(H2O2)<![]() mol/(L·min)
mol/(L·min)
C.反应至6min时,c(H2O2)=0.3mol/L
D.反应至6min时,H2O2分解了50%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液溶质的质量分数为10%,下面说法正确的是( )
①在100份质量溶液中含有10份质量溶质;②在110份质量溶液中含有10份质量溶质;
③在100份质量溶剂中含有10份质量溶质;④在90份质量溶剂中溶有10份质量溶质。
A. ①② B. ③④ C. ②③ D. ①④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组以 H2O2 分解为例,研究浓度、催化剂、溶液酸碱性对反应速率的影响,在常温下按照如下方案完成实验。
实验编号 | 反应物 | 催化剂 |
① | 10 mL 2% H2O2 溶液 | 无 |
② | 10 mL 5% H2O2 溶液 | 无 |
③ | 10 mL 5% H2O2 溶液 | 1 mL 0.1 mol L-1 FeCl3 溶液 |
④ | 10 mL 5% H2O2 溶液+少量 HCl 溶液 | 1 mL 0.1 mol L-1 FeCl3 溶液 |
⑤ | 10 mL 5% H2O2 溶液+少量 NaOH溶液 | 1 mL 0.1 mol L-1 FeCl3 溶液 |
(1)催化剂能加快化学反应速率的原因是_____。
(2)实验①和②的目的是_________。实验时由于较长时间没有观察到明显现象而无法得出结论。资料显示,通常条件下 H2O2 稳定,不易分解。为了达到实验目的,你对原实验方案的改进是_____。
(3)写出实验③的化学反应方程式:_____。
(4)实验③、④、⑤中,测得生成氧气的体积随时间变化的关系如图。分析如图能够得出的实验结论是_____。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关反应的离子方程式书写正确的是
A.氯气溶于水:Cl2+H2O=2H++Cl-+ClO-
B.钠与CuSO4溶液反应:2Na+Cu2+=Cu+2Na+
C.碳酸钙中滴加盐酸:CaCO3+2H+=Ca2++CO2↑+H2O
D.稀硫酸和氢氧化钡溶液反应:SO42-+Ba2+=BaSO4↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,在容积固定的某密闭容器中发生的反应N2+3H2![]() 2NH3在10s内N2的浓度由5molL-1降至4molL-l。下列说法正确的是
2NH3在10s内N2的浓度由5molL-1降至4molL-l。下列说法正确的是
A.充分反应后,N2、H2中至少有一种物质浓度可降为零
B.使用合适的催化剂,可以加快该反应的速率
C.增加H2的浓度或降低温度都会加快该反应的速率
D.用NH3表示的化学反应速率为0.1mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NiSO4、NiCl2是制取高纯镍和电镀行业的重要原料,回答下列问题:
(1)碱性条件下利用肼(N2H2)还原NiCl2溶液可生成高纯Ni纳米粒子和某气体单质,写出反应的离子方程式_________________________________。温度对反应时间和Ni粒径的影响如图所示,温度为___________(选填字母)℃时,很难形成纳米级别的Ni(已知纳米级别的Ni与胶体分散质的大小一致)。
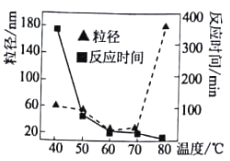
A.43 B.50 C.64 D.79
(2)利用某含镍废料(主要成分为Ni,还含有铝、铁的氧化物)可制备硫酸镍晶体(NiSO4·7H2O),其流程如图所示:

已知:Ksp[Ni(OH)2]=2.0×10-15 K sp[Fe(OH)2]=8.0×10-16
K sp[Fe(OH)3]=4.0×10-38
①写出“氧化”步骤中发生反应的化学方程式_________________________________,步骤需要控制温度40℃左右,其目的是_________________________________。
②已知“酸浸”所得滤液中c(Ni2+)=1mol/L,c(Fe2+)=0.1mol/L,试通过计算证明“氧化”步骤的必要性__________________________________________________________________(离子浓度小于1×10-5mol/L时可认为沉淀完全,要有计算过程和合理的文字叙述)。
③“系列操作”包括__________、冷却结晶、过滤、乙醇洗涤、干燥等操作,其中利用乙醇洗涤硫酸镍晶体的优点是____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了研究化学反应A+B===C+D的能量变化情况,某同学设计了如图所示装置。当向盛有A的试管中滴加试剂B时,看到U形管中甲处液面下降乙处液面上升。试回答下列问题:

(1)该反应为____________反应(填“放热”或“吸热”)。
(2)反应物化学键断裂吸收的能量________(填“高”或“低”)于生成物化学键形成放出的能量。
(3)写出一个符合题中条件的化学方程式:_______________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com