
【题目】已知在200℃,101kPa下,氢气与碘蒸气混合发生应:H2(g)+I2(g)![]() 2HI(g),则下列叙述正确的是( )
2HI(g),则下列叙述正确的是( )
A.反应达平衡后,增大压强(缩小容器体积),混合气体颜色不变
B.由反应需在200℃进行可推测该反应是吸热反应
C.反应达平衡后,保持容器体积不变,充入大量I2蒸气可提高H2的转化率
D.当v(H2)生成:v(HI)生成=2:1时,反应达到平衡状态
科目:高中化学 来源: 题型:
【题目】某课外小组分别用如图所示装置对原电池和电解池原理进行实验探究。
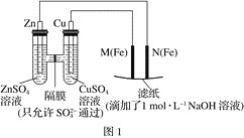
请回答:
Ⅰ.用图1所示装置进行第一组实验。
(1)在保证电极反应不变的情况下,不能替代Cu作电极的是____(填序号)。
A.铝 B.石墨 C.银 D.铂
(2)N极发生反应的电极反应为___。
(3)实验过程中,SO42-___(填“从左向右”、“从右向左”或“不”)移动;滤纸上能观察到的现象有___。
Ⅱ.用图2所示装置进行第二组实验。实验过程中,两极均有气体产生,Y极区溶液逐渐变成紫红色;停止实验,铁电极明显变细,电解液仍然澄清。查阅资料发现,高铁酸根(FeO42-)在溶液中呈紫红色。
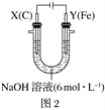
(4)电解过程中,X极区溶液的pH___(填“增大”、“减小”或“不变”)。
(5)电解过程中,Y极发生的电极反应为Fe-6e-+8OH-=FeO42-+4H2O、___。
(6)若在X极收集到672mL气体,在Y极收集到168mL气体(均已折算为标准状况下的气体体积),则Y电极(铁电极)质量减少___g。
(7)在碱性锌电池中,用高铁酸钾作为正极材料,电池反应:2K2FeO4+3Zn=Fe2O3+ZnO+2K2ZnO2,该电池正极发生的反应的电极反应为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学为检验某溶液中是否含有常见的四种无机离子,进行了如图所示的实验操作.其中检验过程中产生的气体能使湿润的红色石蕊试纸变蓝.由该实验能得到的正确结论是![]()
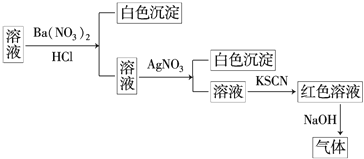
A.原溶液中一定含有![]() B.原溶液中一定含有
B.原溶液中一定含有![]()
C.原溶液中一定含有![]() D.原溶液中一定含有
D.原溶液中一定含有![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中含有的离子可能是K+、Ba2+、Al3+、Mg2+、AlO2-、CO32-、SiO32-、Cl-中的几种,现进行如下实验:
①取少量溶液,加氢氧化钠溶液过程中无沉淀生成;
②另取少量原溶液,逐滴加入5mL0.2mol·L-1盐酸,产生的现象是:开始产生沉淀并逐渐增多,沉淀量基本不变后产生气体,最后沉淀逐渐减少至消失;
③在上述②沉淀消失后的溶液中,再加入足量的硝酸银溶液可得到沉淀0.287g。
下列说法中正确的是( )
A.该溶液中一定不含Ba2+、Mg2+、Al3+、SiO32-、Cl-
B.该溶液中一定含有K+、AlO2-、CO32-、Cl-
C.该溶液是否有K+需做焰色反应实验(透过蓝色钴玻璃片)
D.可能含有Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜板上铁铆钉长期暴露在潮湿的空气中,形成一层酸性水膜后铁铆钉会被腐蚀,示意图如图所示。下列说法不正确的是
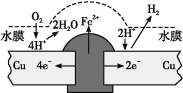
A.因铁的金属性比铜强,所以铁铆钉被氧化而腐蚀
B.若水膜中溶解了SO2,则铁铆钉腐蚀的速率变小
C.铜极上的反应是2H++2e =H2↑、O2+4e+4H+=2H2O
D.在金属表面涂一层油脂,能防止铁铆钉被腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述不相符的是( )
A.图①表示某放热反应在无催化剂(a)和有催化剂(b)时反应的能量变化,且加入催化剂降低了反应的活化能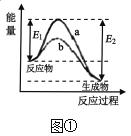
B.图②表示Al3+与OH-反应时溶液中含铝微粒浓度变化的曲线,a点溶液中存在大量AlO2- 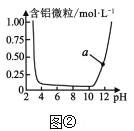
C.图③表示已达平衡的某反应在时改变某一条件后反应速率随时间变化的曲线,则改变的条件不一定是加入催化剂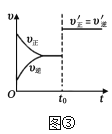
D.图④表示向某明矾溶液中加入Ba(OH)2溶液,生成沉淀的质量与加入Ba(OH)2溶液的体积的关系,在加入20mLBa(OH)2溶液时铝离子恰好沉淀完全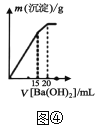
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组用中和滴定法测定一瓶烧碱溶液的浓度(该烧碱溶液中不含与酸反应的杂质),测定过程如下:
a.将锥形瓶置于酸式滴定管下,锥形瓶下垫一张白纸;
b.分别取25.00mL酸、碱滴定管各一支,洗涤并用待装液润洗;
c.打开酸式滴定管旋塞开始滴定直到终点,记录下终点时滴定管上的读数;
d.取一个用蒸馏水洗净的锥形瓶,从碱式滴定管中放出20.00mL待测碱液于锥形瓶中,滴入2至3滴酚酞试液;
e.碱式滴定管中加入待测烧碱溶液,酸式滴定管中加入0.1000mol·L-1的稀盐酸标准溶液,并将两支滴定管尖嘴部分的气泡均赶尽,记下液面刻度;
f.再重复上述操作2次。
三次测定获得的数据如下表:
实验次数 | 待测液体积(mL) | 标准盐酸体积(mL) | |
滴定前读数 | 滴定后读数 | ||
1 | 20.00 | 0.45 | 24.40 |
2 | 20.00 | 2.20 | 26.25 |
3 | 20.00 | 0.10 | 17.10 |
(1)上述实验操作的正确顺序是___(填字母序号)。
(2)实验中,除用酚酞作指示剂外,还可以选用___作该实验的指示剂,在锥形瓶下垫一张白纸的作用是___。
(3)如何判断滴定达到了终点?___
(4)根据实验数据,计算待测碱液的浓度为___mol·L-1(保留两位小数)。
(5)下列操作中可能使所测烧碱溶液的浓度数值偏低的是___。(填正确答案标号)
A.操作b中,未润洗酸式滴定管
B.操作e中,碱式滴定管尖嘴处的气泡未赶出,而取液后其尖嘴处的气泡消失了
C.操作d中,装碱液时,锥形瓶中还有少量蒸馏水
D.操作c中,滴定终点时发现酸式滴定管尖嘴处悬挂着一滴溶液
E.酸式滴定管读数时,滴定前仰视读数,滴定结束时俯视读数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】50ml浓H2SO4溶液(足量)中加入3.2gCu,在加热条件下充分反应:
(1)反应消耗的H2SO4的物质的量是_____________生成SO2的体积为(标准状况下)____________mL.
(2)若题干中浓硫酸的物质的量浓度为amol/L,投入足量的铜片加热,充分反应后,被还原的硫酸的物质的量n(H2SO4)____0.025amol(填“等于”、“大于”或“小于”).
(3)将题干中反应后的溶液稀释到500mL,取出50mL,并向取出液中加入足量的BaCl2溶液,得到沉淀19.81g,则原浓硫酸的物质的量浓度为_____________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A.分子式为C15H16O2的部分同分异构体中可能含有联苯结构单元
B.1.0 mol的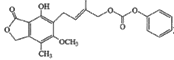 最多能与含4.0 mol NaOH的水溶液完全反应
最多能与含4.0 mol NaOH的水溶液完全反应
C.乳酸薄荷醇醋(![]() )能发生水解、氧化、消去反应
)能发生水解、氧化、消去反应
D.CH3COOCH2CH3与CH3CH2COOCH3互为同分异构体,核磁共振氢谱显示两者均有三种不同的氢原子且三种氢原子的比例相同,故不能用核磁共振氢来鉴别
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com