
【题目】铜板上铁铆钉长期暴露在潮湿的空气中,形成一层酸性水膜后铁铆钉会被腐蚀,示意图如图所示。下列说法不正确的是
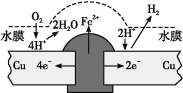
A.因铁的金属性比铜强,所以铁铆钉被氧化而腐蚀
B.若水膜中溶解了SO2,则铁铆钉腐蚀的速率变小
C.铜极上的反应是2H++2e =H2↑、O2+4e+4H+=2H2O
D.在金属表面涂一层油脂,能防止铁铆钉被腐蚀
科目:高中化学 来源: 题型:
【题目】NA表示阿伏加德罗常数的值,下列说法正确的是( )
A.标准状况下,11.2LNO2完全溶于水,转移电子数为0.5NA
B.20gD2O和HTO两种水的组合中含有的中子数为10NA
C.一定温度下,1molH2和足量碘蒸气反应产生的H-I键数目为2NA
D.标准状况下,22.4L的HF中含有的原子数目为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为进行某些实验的探究,某兴趣小组设计了如下装置。

(1)为探究浓硫酸与木炭反应的全部产物,分液漏斗中盛浓硫酸,圆底烧瓶中放木炭。
①装置B中试剂的名称是________。
②装置C、D、E中所盛放的试剂分别是品红、酸性KMnO4溶液和澄清的石灰水。C装置的作用是________,确认产物中含有CO2的实验现象是________。
(2)为了制取无水氯化铜,上述装置中的分液漏斗中盛浓盐酸,圆底烧瓶中放MnO2,B中放铜粉并在玻璃管下添加酒精灯,且将B装置平移至D与E之间。
①此时C、D中依次加入的试剂分别是________。
②若E中为NaOH溶液用于尾气吸收,常温下发生反应的离子方程式为________。
③实验结束时,应首先熄灭装置B下面的酒精灯,其目的是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某地环保部门将收集到的一定量酸雨试样分成甲、乙、丙、丁四份,进行如图所示的实验探究。
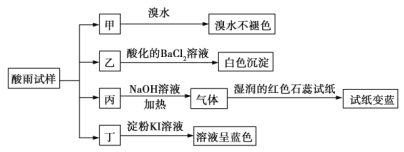
已知酸雨试样中可能含有下表所示的某些离子:
阳离子 |
|
阴离子 |
|
请回答下列问题:
(1)![]() 是______,
是______,![]() 是______。
是______。
(2)可能存在的阴离子是______,能证明该阴离子是否存在的简单实验操作为______。
(3)写出丁试样中滴加淀粉![]() 溶液所发生反应的离子方程式:______。
溶液所发生反应的离子方程式:______。
(4)某次降雨收集到![]() 雨水,向雨水中滴加
雨水,向雨水中滴加![]() 的
的![]() 溶液,充分反应后测得溶液中
溶液,充分反应后测得溶液中![]() ,再向该溶液中加入足量的
,再向该溶液中加入足量的![]() 溶液,经过滤、蒸干、称重,测得沉淀的质量为
溶液,经过滤、蒸干、称重,测得沉淀的质量为![]() 。假设雨水的酸性仅由
。假设雨水的酸性仅由![]() 和
和![]() 的排放所致,则排放到空气中的
的排放所致,则排放到空气中的![]() 和
和![]() 的物质的量之比约为______(不考虑
的物质的量之比约为______(不考虑![]() 的相互反应)。
的相互反应)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化硫是重要的工业原料,探究其制备方法和性质具有非常重要的意义。
(1)工业上用黄铁矿(主要成分为![]() ,其中硫元素为
,其中硫元素为![]() 价)在高温条件下和氧气反应制备
价)在高温条件下和氧气反应制备![]() :
: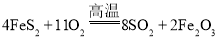 ,该反应中被氧化的元素是______(填元素符号)。当该反应转移
,该反应中被氧化的元素是______(填元素符号)。当该反应转移![]() 电子时,生成的二氧化硫在标准状况下的体积为______
电子时,生成的二氧化硫在标准状况下的体积为______![]() 。
。
(2)实验室中用下列装置测定![]() 被催化氧化为
被催化氧化为![]() 的转化率。(已知
的转化率。(已知![]() 的熔点为
的熔点为![]() ,假设气体进入装置时均被完全吸收,且忽略空气中
,假设气体进入装置时均被完全吸收,且忽略空气中![]() 的影响)
的影响)
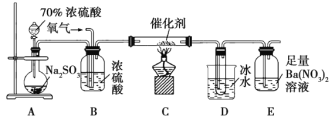
①简述使用分液漏斗向圆底烧瓶中滴加浓硫酸的操作:______。
②当停止通入![]() ,熄灭酒精灯后,需要继续通一段时间的氧气,其目的是______。
,熄灭酒精灯后,需要继续通一段时间的氧气,其目的是______。
③实验结束后,若装置![]() 增加的质量为mg,装置
增加的质量为mg,装置![]() 中产生白色沉淀的质量为ng,则此条件下二氧化硫的转化率是______(用含字母的代数式表示,不用化简)。
中产生白色沉淀的质量为ng,则此条件下二氧化硫的转化率是______(用含字母的代数式表示,不用化简)。
(3)某学习小组设计了如图所示装置来验证二氧化硫的化学性质。
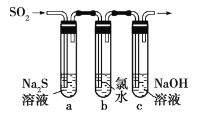
①能说明二氧化硫具有氧化性的实验现象为______。
②为验证二氧化硫的还原性,反应一段时间后,取试管![]() 中的溶液分成三份,分别进行如下实验。
中的溶液分成三份,分别进行如下实验。
方案Ⅰ:向第一份溶液中加入![]() 溶液,有白色沉淀生成
溶液,有白色沉淀生成
方案Ⅱ:向第二份溶液中加入品红溶液,红色褪去
方案Ⅲ:向第三份溶液中加入![]() 溶液,产生白色沉淀
溶液,产生白色沉淀
上述方案合理的是______(填“Ⅰ”“Ⅱ”或“Ⅲ”);试管![]() 中发生反应的离子方程式为______。
中发生反应的离子方程式为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知在200℃,101kPa下,氢气与碘蒸气混合发生应:H2(g)+I2(g)![]() 2HI(g),则下列叙述正确的是( )
2HI(g),则下列叙述正确的是( )
A.反应达平衡后,增大压强(缩小容器体积),混合气体颜色不变
B.由反应需在200℃进行可推测该反应是吸热反应
C.反应达平衡后,保持容器体积不变,充入大量I2蒸气可提高H2的转化率
D.当v(H2)生成:v(HI)生成=2:1时,反应达到平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一个2L的恒容密闭容器中,加入3molA和1molB发生如下反应:3A(g)+B(g)![]() 2C(g)+3D(?)。5min后达到平衡,C的浓度为0.6mol·L-1。达到平衡后,当升高温度时,A的转化率变大;当减小压强时,混合体系中C的质量分数减小,则:
2C(g)+3D(?)。5min后达到平衡,C的浓度为0.6mol·L-1。达到平衡后,当升高温度时,A的转化率变大;当减小压强时,混合体系中C的质量分数减小,则:
(1)该反应的正反应是___反应(填“吸热”或“放热”),D的状态是__(填“气态”或“非气态”)。
(2)达到平衡时,A的转化率为___,此温度下的平衡常数K=___(保留两位小数)。
(3)若加入适量B,则A的转化率将___(填“增大”“减小”或“不变”,下同),化学平衡常数将__。
(4)若B是有色物质,A、C均为无色物质,则上述反应达到平衡后:
①再加入适量A时,混合物的颜色___(填“变浅”“变深”或“不变”,下同);
②再加入适量C时,混合物的颜色__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某1L待测溶液中除含有0.2 mol·L-1的Na+外,还可能含有下列离子中的一种或多种:
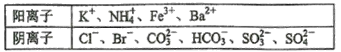
现进行如下实验操作(每次实验所加试剂均过量)
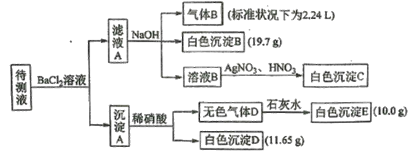
下列说法不正确的是
A.向溶液B中加AgNO3与HNO3的操作是多余的,待测液中一定含有的离子是K+、NH4+、CO32-、HCO3-、且c(K+)≥0.1mol·L-1
B.生成白色沉淀B的离子方程式为Ba2++HCO3-+OH-=BaCO3↓+H2O
C.已知白色沉淀C能溶于浓氨水,离子方程式为AgCl+2NH3·H2O=Ag(NH3)2++Cl-+2H2O
D.若无色气体D是混合气体,则沉淀A的成分可能是BaCO3、BaSO3、BaSO4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com