
【题目】MgSO4·7H2O在医药上常用做泻药,工业上可用氯碱工业中的一次盐泥为原料生产已知一次盐泥中含有镁、钙、铁、铝、锰的硅酸盐和碳酸盐等成分其主要工艺如下:
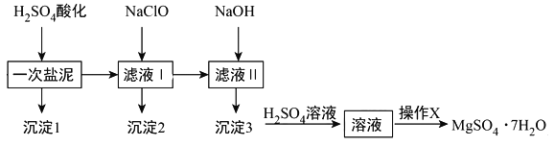
请回答下列问题:
(1)一次盐泥与H2SO4充分反应后,分离沉淀1与滤液I时所用到的玻璃仪器有玻璃棒和___________、____________.
(2)“操作X”是将溶液____________、____________、过滤洗涤,即得到MgSO4·7H2O晶体.
(3)加NaClO溶液至pH=5~6并加热煮沸5-10分钟,沉淀2中主要含有MnO2和另外两种难溶物,这两种难溶物的化学式分别为___________、___________;其中NaClO溶液将MnSO4转化为MnO2的离子方程式为_________________________________.
(4)检验滤液Ⅱ中是否含有Fe3+的实验方法是__________________________.
(5)称量制得的样品5g,用200mL水溶解,加入2mol/L的盐酸5mL,在不断搅拌下滴加足量2mol/LBaCl2溶液,充分反应后,得沉淀4.66 g,则样品纯度为_______。
【答案】烧杯 漏斗 蒸发浓缩(或加热浓缩) 冷却结晶(或降温结晶) Fe(OH)3或Fe2O3 Al(OH)3或Al2O3 ClO-+Mn2++H2O=MnO2+Cl-+2H+ 取滤液II 1-2mL于试管中,加入少量的KSCN溶液,若不变红色,证明滤液Ⅱ中无Fe3+,反之若变为红色,则证明滤液Ⅱ中含有Fe3+ 98.4%
【解析】
一次盐泥中含有镁、钙、铁、铝、锰的硅酸盐和碳酸盐等成分,加入硫酸反应生成硫酸镁,硫酸钙,硫酸铁,硫酸铝,硫酸锰,会把碳酸盐和硅酸盐转化为溶于水的硫酸盐,得到的沉淀1主要为H2SiO3、CaSO4,过滤,滤液加入次氯酸钠是为了氧化锰离子为二氧化锰,同时溶液中Fe3+、Al3+水解生成Fe(OH)3、Al(OH)3沉淀,所以沉淀2为MnO2、Fe(OH)3、Al(OH)3,过滤,在滤液中加入氢氧化钠生成氢氧化镁沉淀,所以沉淀3为Mg(OH)2,氢氧化镁中加入硫酸得到硫酸镁溶液,将溶液经过加热浓缩,冷却结晶,过滤、洗涤、干燥等操作,获得MgSO47H2O晶体,据此分析作答。
(1)分离沉淀1与滤液I属于过滤操作,则所用到的玻璃仪器有玻璃棒、烧杯和漏斗,故答案为:烧杯;漏斗;
(2)硫酸镁溶液经过蒸发浓缩(或加热浓缩)、冷却结晶(或降温结晶)和过滤洗涤,即得到MgSO4·7H2O晶体,故答案为:蒸发浓缩(或加热浓缩);冷却结晶(或降温结晶);
(3)加入硫酸反应生成硫酸镁,硫酸铝,硫酸铁,加入次氯酸钠是为了氧化锰离子为二氧化锰,调节溶液pH,Fe3+、Al3+水解生成Fe(OH)3、Al(OH)3沉淀,受热分解分别得到Fe2O3和Al2O3;NaClO溶液在加热条件下将溶液中的Mn2+氧化成MnO2,反应的离子方程式为Mn2++ClO-+H2O=MnO2↓+2H++Cl-,故答案为:Fe(OH)3或Fe2O3;Al(OH)3或Al2O3;Mn2++ClO-+H2O=MnO2↓+2H++Cl-;
(4)Fe3+离子与KSCN溶液生成血红色的Fe(SCN)3,可利用该反应进行检验,故答案为:取滤液II 1-2mL于试管中,加入少量的KSCN溶液,若不变红色,证明滤液Ⅱ中无Fe3+,反之若变为红色,则证明滤液Ⅱ中含有Fe3+;
(5)准确称量制得的样品5g,用200mL水溶解,加入2molL-1的盐酸5mL,在不断搅拌下滴加足量2molL-1 BaCl2溶液,充分反应后,得沉淀4.66g,生成沉淀BaSO4物质的量=![]() =0.02mol,则MgSO47H2O物质的量为0.02mol,质量=0.02mol×246g/mol=4.92g,样品纯度=
=0.02mol,则MgSO47H2O物质的量为0.02mol,质量=0.02mol×246g/mol=4.92g,样品纯度=![]() ×100%=98.4%,故答案为:98.4%。
×100%=98.4%,故答案为:98.4%。


科目:高中化学 来源: 题型:
【题目】常温下,下列反应的平衡常数的数值如下:
2NO(g)![]() N2(g)+O2(g) K1=1×1030;
N2(g)+O2(g) K1=1×1030;
2H2(g)+O2(g)![]() 2H2O(g) K2=2×1081;
2H2O(g) K2=2×1081;
2CO2(g)![]() 2CO(g)+O2(g) K3=4×10-92。
2CO(g)+O2(g) K3=4×10-92。
以下说法正确的是( )
A.常温下,NO分解产生O2的反应的平衡常数表达式为K1=c(N2)·c(O2)
B.常温下,水分解产生O2,此时平衡常数的数值约为5×10-82
C.常温下,NO、H2O、CO2三种化合物分解放出O2的倾向由大到小的顺序为NO>H2O>CO2
D.以上说法都不正确
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】12 mL 0.1 mol·L-1的Na2SO3溶液恰好与20 mL 0.02 mol·L-1的K2Cr2O7(重铬酸钾)溶液完全反应。已知Na2SO3被K2Cr2O7氧化为Na2SO4,则Cr在还原产物中的化合价为( )
A. +2 B. +3 C. +4 D. +5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W、R、I、Q为前30号元素,且原子序数依次增大.X是所有元素中原子半径最小的,Y有三个能级,且每个能级上的电子数相等,Z原子单电子数在同周期元素中最多,W与Z同周期,第一电离能比Z的低,R与Y同一主族,I的原子序数是W的两倍,Q的最外层只有一个电子,其他电子层电子均处于饱和状态.请回答下列问题:
(1)Q+核外电子排布式为___________,Y的电子排布图为_________________________
(2)化合物ZX3中Z原子的杂化方式为___________,ZW2- 离子的立体构型是___________;
(3)①Y、R的最高价氧化物的沸点较高的是___________(填化学式),原因是___________;
②W与I的简单氢化物中W的熔沸点更高,原因是______________________
(4)向Q元素的硫酸盐溶液中通入足量ZX3,充分反应后溶液呈深蓝色,该反应的离子方程式为__________________________________________________;
(5)Y有多种同素异形体,其中一种同素异形体的晶胞结构如图,该晶体一个晶胞的Y原子数为___________,Y原子的配位数为___________,若晶胞的边长为a pm,晶体的密度为ρ g/cm3,则阿伏加德罗常数的数值为___________(用含a和ρ的代数式表示)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国化工专家侯德榜的“侯氏制碱法” 又叫“联合制碱法”以NaCl、NH3、CO2等为原料先制得NaHCO3,进而生产出纯碱Na2CO3,有关反应的化学方程式:
(1)______________。
(2)______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学设计下列实验装置进行氯气的性质实验。玻璃管内装有分别滴有不同溶液的棉球,反应一段时间后,对图中指定部位颜色描述正确的是()

① | ② | ③ | ④ | |
A | 白色 | 先变红色后无色 | 橙色 | 蓝色 |
B | 无色 | 红色 | 橙色 | 紫色 |
C | 无色 | 白色 | 橙色 | 蓝色 |
D | 白色 | 无色 | 无色 | 紫色 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知KMnO4与浓HCl在常温下反应能产生Cl2。若用下图所示的实验装置来制备纯净、干燥的氯气,并试验它与金属的反应。每个虚线框表示一个单元装置,其中错误的是( )

A.只有①和②处B.只有②处C.只有②和③处D.只有②③④处
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对金属制品进行搞腐蚀处理,可延长其使用寿命。
(1)以下为铝村表面处理的一种方法:
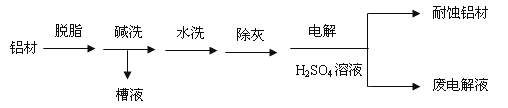
①碱洗的目的是除去铝村表面的自然氧化膜,碱洗衣时候常有气泡冒出,原因是:________(用离子方程式表示)。为将碱洗槽液中的铝以沉淀形式回收,最好向槽液中加入下列试剂中的__________。
a.NH3b.CO2c.NaOH d.HNO3
②以铝村为阳极,在H2SO4溶液中电解,铝村表面形成氧化膜,阳极电极反应式为:_____。
取少量废电解液,加入NaHCO3溶液后产生气泡和白色沉淀,产生沉淀的原因是_________。
(2)镀铜可防止铁制品腐蚀,电镀时用铜而不用石墨做阳极的原因是 。
(3)利用下图装置,可以模拟铁的电化学防护。

若X为碳棒,为减缓铁的腐蚀,开关K应该置于 处。
若X为锌,开关K置于M处,该电化学防护法称为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下图所示装置进行下列实验:将①中溶液滴入②中,预测的现象与实际相符的是

选项 | ①中物质 | ②中物质 | 预测②中的现象 |
A. | 稀盐酸 | 碳酸钠与氢氧化钠的混合溶液 | 立即产生气泡 |
B. | 浓硝酸 | 用砂纸打磨过的铝条 | 产生红棕色气体 |
C. | 氯化铝溶液 | 浓氢氧化钠溶液 | 产生大量白色沉淀 |
D. | 草酸溶液 | 高锰酸钾酸性溶液 | 溶液逐渐褪色 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com