
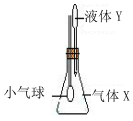
 在如图所示示装置中,将液体Y滴入瓶中并摇动,一会儿小气球胀大.则气体X与液体Y可能是( )
在如图所示示装置中,将液体Y滴入瓶中并摇动,一会儿小气球胀大.则气体X与液体Y可能是( )| A | B | C | D | |
| 气体X | NH3 | SO2 | CO2 | HCl |
| 液体Y | 稀硫酸 | 浓NaOH | 饱和NaHCO3 | 水 |
| A. | A | B. | B | C. | C | D. | D |
 出彩同步大试卷系列答案
出彩同步大试卷系列答案科目:高中化学 来源: 题型:选择题
| A. | a>c+d | B. | 平衡向正反应方向移动 | ||
| C. | D的体积分数变大 | D. | A的转化率变小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 难溶电解质 | AgI | AgOH | Ag2S | PbI2 | Pb(OH)2 | PbS |
| KSP | 8.3×10-17 | 5.6×10-8 | 6.3×10-50 | 7.1×10-9 | 1.2×10-15 | 3.4×10-23 |
| 实验编号 | 起始浓度/mol/L | 反应后溶液的pH | |
| c (HA) | c (NaOH) | ||
| ① | 0.10 | 0.10 | 9 |
| ② | X | 0.05 | 7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 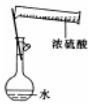 配制一定物质的量浓度的稀硫酸 | B. | 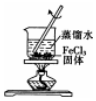 制取少量的Fe(OH)3胶体 | ||
| C. | 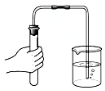 检查气密性 | D. | 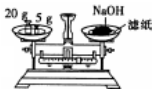 称量NaOH固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 最高价氧化物对应水化物的碱性大小顺序一定是:X>Y | |
| B. | 离子半径和原子半径由大到小的顺序均为X>Y>Z>W | |
| C. | 氢化物的稳定性是Z<W | |
| D. | 还原性Z m->W(m+1)-,氧化性Xn+>Y(n+1)+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 容量瓶使用前经蒸馏水清洗后没有干燥 | |
| B. | 配制过程中,未用蒸馏水洗涤烧杯和玻璃棒 | |
| C. | 俯视确定凹液面与刻度线相切 | |
| D. | 用敞口容器称量NaOH且时间过长 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com