
| A. | c(CH3COOH)+c(CH3COO-)=0.01mol•L-1 | |
| B. | c(H+)=c(CH3COO-) | |
| C. | 加水稀释100倍后,溶液pH=4 | |
| D. | 加入醋酸钠固体,可抑制醋酸的电离 |
分析 醋酸溶液中,存在电离平衡CH3COOH?CH3COO-+H+,
A、根据物料守恒分析解答;
B、溶剂水还电离出氢离子;
C、加水稀释,促进醋酸的电离;
D、同离子效应.
解答 解:A、醋酸电离极微弱,根据物料守恒,c(CH3COOH)+c(CH3COO-)>c(H+)=0.01mol•L-1,故A错误;
B、醋酸电离产生氢离子和醋酸根离子的浓度相等,而溶剂水还电离出氢离子,所以c(H+)>c(CH3COO-),故B错误;
C、加水稀释,促进醋酸的电离,所以加水稀释100倍后,溶液pH<4,故C错误;
D、加入醋酸钠固体,醋酸根离子浓度变大,根据同离子效应,电离平衡逆向移动,可抑制醋酸的电离,故D正确;
故选D.
点评 本题考查了影响弱电解质电离的因素,难度不大,注意:如果加入含有相同离子的物质就抑制其电离,如果加入和弱电解质电离的离子发生反应的物质就促进其电离.


 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | Mg2+、K+、SO42-、NO3- | B. | Ba2+、Mg2+、SO42+、Cl- | ||
| C. | OH-、K+、Na+、H+ | D. | H+、K+、Cl-、CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 彩色密封塑胶袋能造成白色污染 | |
| B. | 钠、氧化钠、氢氧化钠都能与醋酸反应得到醋酸钠 | |
| C. | 化学变化都伴随着能量的变化 | |
| D. | 大多数合金比各成分金属硬度小,熔点低 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
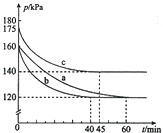 化合物AX3和单质X2在一定条件下反应可生成化合物AX5.回答下列问题:
化合物AX3和单质X2在一定条件下反应可生成化合物AX5.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
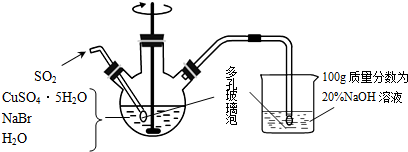
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 化学键 | H-H | C-O | C≡O | H-O | C-H |
| E/(kJ•mol-1) | 436 | 343 | 1076 | 465 | 413 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 与铝反应生成大量氢气的溶液中:Mg2+、K+、HCO3-、NO3- | |
| B. | 0.1mol/L的NaNO3溶液中:K+、I-、Cl-、SO42- | |
| C. | 铁与稀硫酸反应后的溶液中:[Fe(CN)6]3-、NH4+、Cl-、NO3- | |
| D. | 空气中:SO2、NO、N2、NH3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com