
【题目】设 NA为阿伏加德罗常数的值,下列说法正确的是
A. 标准状况下,22.4LCHCl3 中含有氯原子数目为 3NA
B. 18g D2O 和 18g H2O 中含有的质子数均为 10NA
C. 4.6gNa 与 O2反应生成 Na2O 和 Na2O2 混合物时失去的电子数为 0.2NA
D. 25℃时 pH=13 的 Ca(OH)2溶液中含有 OH-的数目为 0.1NA
【答案】C
【解析】
A.标准状况下CHCl3为液态,无法计算22.4LCHCl3的物质的量,所以不能确定标准状况下22.4LCHCl3中氯原子数目。A项错误;
B.每个D2O分子中含有10个质子,D2O的摩尔质量为20g/mol,18gD2O的物质的量=![]() =0.9mol,18gD2O中含有的质子数=0.9NA×10=9NA,B项错误;
=0.9mol,18gD2O中含有的质子数=0.9NA×10=9NA,B项错误;
C.反应中每个Na原子失去1个电子,4.6gNa的物质的量=![]() =0.2mol,4.6gNa完全反应时失去的电子数=0.2NA×1=0.2NA,C项正确;
=0.2mol,4.6gNa完全反应时失去的电子数=0.2NA×1=0.2NA,C项正确;
D. pH=13的Ca(OH)2溶液中c(OH-)=![]() =
=![]() =0.1mol/L,因溶液的体积未知,无法通过公式n=c·V计算溶液中OH-的数目,D项错误;答案选C。
=0.1mol/L,因溶液的体积未知,无法通过公式n=c·V计算溶液中OH-的数目,D项错误;答案选C。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】已知a、b、c的分子式均为C4H8O2,其结构简式如下图所示,下列说法正确的是
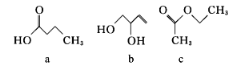
A. a、b均能使酸性KMnO4溶液褪色 B. a、b、c均可与氢氧化钠溶液反应
C. a、b、c中只有b的所有原子处于同一平面 D. c的二氯代物有六种(不考虑立体异构)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子在强碱性溶液中能大量共存的是
A.Mg2+、Na+、NO3-、SO42-B.Na+、K+、ClO-、I-
C.Na+、K+、HCO3-、SO42-D.Ba2+、Na+、Cl-、NO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】芳香族化合物 A(C9H12O)常用于药物及香料的合成,A 有如下转化关系:
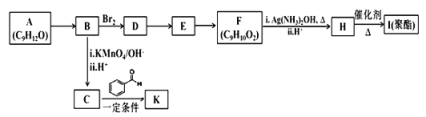
已知以下信息:①A 是芳香族化合物且分子侧链上有处于两种不同环境下的氢原子;
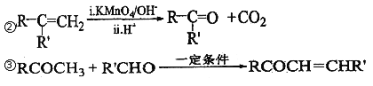
回答下列问题:
(1)B 生成 D 的反应类型为___________,由 D 生成 E 的反应所需的试剂及反应条件为_______。
(2)A 中含有的官能团名称为________________。
(3)K 的结构简式为________________________。
(4)由 F 生成 H 的反应方程式为________________________。
(5)F 有多种同分异构体,符合下列条件的同分异构体有__________种。
①属于芳香族化合物 ②能发生水解反应和银镜反应
(6)糠叉丙酮(![]() )是一种重要的医药中间体,请参考上述合成路线,设计一条由叔丁醇[(CH3)3COH]和糠醛(
)是一种重要的医药中间体,请参考上述合成路线,设计一条由叔丁醇[(CH3)3COH]和糠醛(![]() )为原料制备糠叉丙酮的合成路线(无机试剂任用,用结构简式表示有机物),用箭头表示转化关系,箭头上注明试剂和反应条件)。____________________________
)为原料制备糠叉丙酮的合成路线(无机试剂任用,用结构简式表示有机物),用箭头表示转化关系,箭头上注明试剂和反应条件)。____________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E是核电荷数依次增大的五种短周期主族元素。A元素的原子核内只有1个质子;B元素的原子半径是其所在主族中最小的,B的最高价氧化物对应的水化物的化学式为HBO3;C元素原子的最外层电子数比次外层电子数多4;C的阴离子与D的阳离子具有相同的电子排布,两元素可形成化合物D2C;C、E元素同主族。
(1)B在元素周期表中的位置是_________。
(2)E元素形成的最高价氧化物对应的水化物的化学式为______,由A、B、C三种元素形成的离子化合物的化学式为______。
(3)C、D、E形成的简单离子的半径大小关系是_________(用离子符号表示)。
(4)用电子式表示化合物A2C的形成程:____________________________,化合物D2C2中含有的化学键是____________________________________。
(5)化合物D2C2与A2C反应的化学方程式 ____________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工业含铜废料含有 Cu、CuO、CuS、CuSO4 等成分,利用该含铜废料可生产硝酸铜晶体[Cu(NO3)2·3H2O],生产的工艺流程如图所示,请回答下列问题:
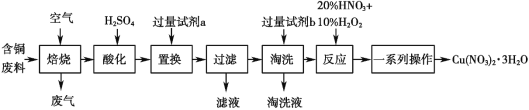
(1)“焙烧”过程中除生成 SO2 的反应外,另外一个反应的化学方程式是______。
(2)“酸化”过程为加快反应速率,可采用的措施有______(写出一条即可)。
(3)若试剂 a 为 Zn,则“置换”的离子方程式为_____。
(4)“淘洗”的作用是_________________。
(5)“反应”一步中使用 20% HNO3 和 10% H2O2,整个过程无红棕色气体产生,则发生反应的离子方程式为_______________________________________;若该步骤只使用 20% HNO3,随着反应的进行,温度升高,出现大量红棕色气体,则还原剂与氧化剂的物质的量之比为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)某温度时,在2 L容器中A、B两种物质间的转化反应中,A、B物质的量随时间变化的曲线如下图所示,由图中数据分析得:
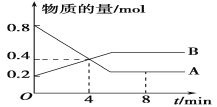
①该反应的化学方程式为____________________;
②反应开始至4 min时,B的平均反应速率为________ ,A的反应速率为_____ ,A的转化率为_____。
③4 min时,反应是否达到平衡状态?________(填“是”或“否”),8 min时,v(正)________v(逆)(填“>”、“<”或“=”)。
(2)下图表示在密闭容器中反应:2SO2(g) + O2(g)![]() 2SO3(g)△H<0达到平衡时,由于条件改变而引起反应速率和化学平衡的变化情况,a时改变的条件可能是______________;b时改变的条件可能是______________。
2SO3(g)△H<0达到平衡时,由于条件改变而引起反应速率和化学平衡的变化情况,a时改变的条件可能是______________;b时改变的条件可能是______________。
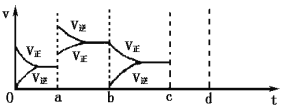
查看答案和解析>>
科目:高中化学 来源: 题型:
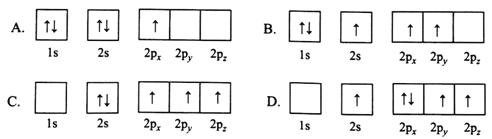
【题目】[化学——选修3:物质结构与性质]硼及其化合物用途非常广泛,回答下列问题。
(1)下列B原子电子排布图表示的状态中,能量最低和最高的分别为________、________(填标号)
(2)H3BO3是一元弱酸,可用作医用消毒剂其水溶液呈酸性的原理为:
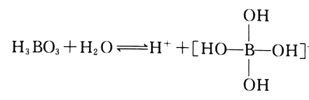
则1mol硼酸分子中含有的共用电子对数为________个。
(3)BF3可用于制造火箭的高能燃料,其分子的空间构型是________________,硼原子杂化方式是________________;BF3能与乙醚发生反应:(C2H5)2O+BF3→BF3·O(C2H5)2,该反应能发生,其原因是________________________________。
(4)硼的一种化合物结构简式为O=B—CH=C=CH2,该分子中含________个σ键。
(5)下图中图(a)为类似石墨的六方BN,图(b)为立方BN。
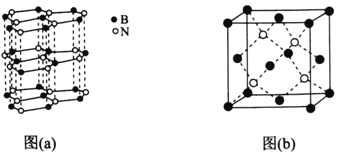
①六方BN具有良好的润滑性,是因为________________________;六方BN不能像石墨一样具有导电性,其原因是________________________。
②已知立方BN的晶胞参数为0.3615nm,阿伏加德罗常数的值为NA,则立方BN的密度为________________g·cm-3(列出计算式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化还原反应是一类重要的反应,在工农业生产、日常生活中都有广泛的用途。
(1)火药是中国的“四大发明”之一,永远值得炎黄子孙骄傲。黑火药在发生爆炸时,发生如下反应:2KNO3+3C+S=K2S+N2↑+3CO2↑。其中被氧化的元素是____________,还原产物是____________。
(2)实验室为监测空气中汞蒸气的含量,往往悬挂涂有CuI的滤纸,根据滤纸是否变色或颜色发生变化所用去的时间来判断空气中的含汞量,其反应为4CuI+Hg=Cu2HgI4+2Cu。
①上述反应产物Cu2HgI4中,Cu元素显________价。
②以上反应中的氧化剂为________,当有1 mol CuI参与反应时,转移电子________mol。
③标明上述反应电子转移的方向和数目。____________________________。
(3)工业上常用酸性高锰酸钾溶液处理含有CuS和Cu2S的矿物,其反应原理如下:
8MnO4—+5Cu2S+44H+=10Cu2++5SO2↑+8Mn2++22H2O
6MnO4—+5CuS+28H+=5Cu2++5SO2↑+6Mn2++14H2O
根据上述反应原理,某学习小组用400 mL 0.075 mol·L-1的酸性高锰酸钾溶液处理2 g含有CuS和Cu2S的混合物。反应后煮沸溶液,赶尽SO2,剩余的KMnO4恰好与350 mL 0.1 mol·L-1的(NH4)2Fe(SO4)2溶液完全反应。
①配平KMnO4与(NH4)2Fe(SO4)2反应的离子方程式:______,MnO![]() +Fe2++H+=Mn2++Fe3++H2O
+Fe2++H+=Mn2++Fe3++H2O
②KMnO4溶液与固体混合物反应后,剩余KMnO4的物质的量为________ mol。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com