
科目:高中化学 来源: 题型:阅读理解


| 32m2 |
| 233m1 |
| 32m2 |
| 233m1 |
| 2.8cV |
| m1 |
| 2.8cV |
| m1 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解


| ||
| ||
| 32m2 |
| 233m1 |
| 32m2 |
| 233m1 |
| 28V |
| m1 |
| 28V |
| m1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
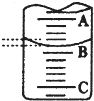 某化学实验小组探究市售食用白醋中醋酸的准确浓度,取25.00 mL某品牌食用白醋于锥形瓶中,在实验室用浓度为cb mol/L的标准NaOH溶液对其进行滴定.
某化学实验小组探究市售食用白醋中醋酸的准确浓度,取25.00 mL某品牌食用白醋于锥形瓶中,在实验室用浓度为cb mol/L的标准NaOH溶液对其进行滴定.| 实验次数 | 第一次 | 第二次 | 第三次 |
| 消耗NaOH溶液体积/mL | 26.02 | 25.35 | 25.30 |
| (23.35+25.30)c |
| 2V |
| (23.35+25.30)c |
| 2V |
查看答案和解析>>
科目:高中化学 来源:2012-2013学年四川省资阳市高三第二次高考模拟考试理综化学试卷(解析版) 题型:计算题
为回收利用废钒催化剂(含有V2O5、VOSO4及不溶性残渣),科研人员最新研制了一种离子交换法回收钒的新工艺。己知:V可形成VO2+、VO2+、VO3-等多种离子;部分含钒物质在水中的溶解性如下表所示:
|
物质 |
VOSO4 |
V2O5 |
NH4VO3 |
(VO2)2SO4 |
|
溶解性 |
可溶 |
难溶 |
难溶 |
易溶 |

该工艺的主要流程如下:
请回答下列问题:
(1)工业上由V2O5冶炼金属钒常用铝热剂法,其反应的化学方程式为 。
(2)反应①的目的是 。
(3)若用NaOH溶液调节pH,则转化②的离子方程式为 。
(4)实验室中实现反应③所需主要仪器除三脚架、泥三角、酒精灯外,必不可少的是 。
(5)V2O5为硫酸工业接触室中的重要催化剂,其催化反应为2SO2(g)+O2(g) 2SO3(g)
ΔH<0,在容积为2.0 L的密闭容器中充入2 mol SO2、1 mol O2,一定条件下达到平衡,SO3的体积分数为
2SO3(g)
ΔH<0,在容积为2.0 L的密闭容器中充入2 mol SO2、1 mol O2,一定条件下达到平衡,SO3的体积分数为 。
。
①该条件下反应2SO2(g)+O2(g) 2SO3(g)
的平衡常数为_____;
2SO3(g)
的平衡常数为_____;
②下列措施能使 增大的是_____。
增大的是_____。
A.升高温度
B.保持温度和容积不变,再充入2 mol He
C.保持温度和容积不变,再充入2 mol SO2和1 mol O2
D.不用V2O5作催化剂,改用其它更高效催化剂
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com