
(9分)生产生活中广泛涉及氧化还原反应。
(1)工业上冶炼下列物质通常不采用电解法的是???????? 。
a.Na???????? b.Mg???????? c.Fe???????? d.Ag
(2)下图为电解精炼铜的示意图,电极a为粗铜,则a连接电源的 ????? 极,b极的电极反应式为?????????????????????? 。

(3)汽车剧烈碰撞时,安全气囊中发生反应NaN3 + KNO3 → K2O + Na2O + X↑(未配平),已知X为单质,在反应中NaN3失去电子。则该反应的氧化剂为??????????????? ,X的化学式为???????? ,该反应的氧化剂和还原剂的物质的量之比为?????????? 。
(4)工业上制取高纯度MnO2的某一步骤如图所示,请写出该反应的离子方程式?????????????????? 。

(1)cd (2分)
(2)正 (1分) Cu2++2e?=Cu (1分)
(3)KNO3? N2?? 1:5? (共3分,各1分)
(4)5Mn2+ + 2ClO3? + 4H2O = 5MnO2↓+ Cl2↑+ 8H+? (2分)
【解析】
试题分析:(1)Na、Mg为活泼金属,无法用还原剂还原化合物制取金属单质,Fe可用还原剂还原化合物制取金属单质,Ag可用加热Ag2O的方法制取Ag,故cd项正确。
(2)电解精炼铜,粗铜为阳极,连接在电源的正极;b极为阴极,电解质溶液中的Cu2+在阴极上得电子,电解方程式为:Cu2++2e?=Cu。
(3)已知X为单质,在反应中NaN3失去电子,可推出X为N2,KNO3中N元素化合价降低,在反应中得电子,所以KNO3为氧化剂;根据氧化反应中氧化剂所得电子总数与还原剂失去电子总数相等,可得n(NaN3)=5n(KNO3),所以氧化剂和还原剂的物质的量之比,即n(KNO3):n(NaN3)=1:5.
(4)根据图示可知,ClO3?把Mn2+氧化为MnO2,可得离子方程式为:5Mn2+ + 2ClO3? + 4H2O = 5MnO2↓+ Cl2↑+ 8H+
考点:本题考查金属的冶炼、电解精炼铜、氧化还原反应原理及应用、离子方程式的书写。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:阅读理解
| O | 2- 7 |
| O | 2- 4 |
| O | 2- 7 |

| 沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 |
| pH | 5.2 | 3.2 | 9.7 | 6.7 |
查看答案和解析>>
科目:高中化学 来源:2013-2014学年北京市延庆县高三第一次模拟理综化学试卷(解析版) 题型:选择题
原电池与电解池在生活和生产中有着广泛应用。下列有关判断中错误的是
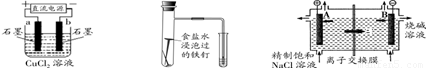
装置① 装置② 装置③
A.装置①研究的是电解CuCl2溶液,b电极上有红色固体析出
B.装置②研究的是金属的吸氧腐蚀,Fe上的反应为Fe-2e- = Fe2+
C.装置③研究的是电解饱和食盐水, B电极发生的反应:2Cl--2e- = Cl2↑
D.三个装置中涉及的主要反应都是氧化还原反应
查看答案和解析>>
科目:高中化学 来源:2012-2013学年北京市通州区高三年级上学期期末摸底考试化学试卷(解析版) 题型:选择题
原电池与电解池在生活和生产中有着广泛应用。下列有关判断中错误的是

装置① 装置② 装置③
A.装置①研究的是金属的吸氧腐蚀,Fe上的反应为Fe-2e = Fe2+
B.装置②研究的是电解CuCl2溶液,它将电能转化为化学能
C.装置③研究的是电解饱和食盐水,电解过程中,B极上发生氧化反应
D.三个装置中涉及的主要反应都是氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
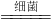 ______Cu2+______Fe2++______H++______S
______Cu2+______Fe2++______H++______S
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com