
【题目】短周期元素R、T、Q、W在元素周期表中的相对位置如图所示,其中T所处的周期序数与族序数相等。下列判断不正确的是
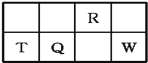
A.最简单气态氢化物的热稳定性:R>Q
B.最高价氧化物对应水化物的酸性:Q<W
C.原子半径:T>Q>R
D.T、Q、W最高价氧化物对应的水化物均能与R的最高价氧化物对应的水化物发生反应
【答案】D
【解析】
由短周期元素R、T、Q、W的位置,可确定T、Q、W为第三周期的元素,R为第二周期元素,T所处的周期序数与族序数相等,则T为Al元素,故Q为Si元素,W为S元素,R为N元素,
A.非金属性N>Si,故最简单气态氢化物的热稳定性为NH3>SiH4,故A正确;
B.非金属性Si<S,故最高价氧化物对应水化物的酸性为H2SiO3<H2SO4,故B正确;
C.同周期自左而右原子半径减小,同主族自上而下原子半径增大,故原子半径:T>Q>R,故C正确;
D.T、Q、W的最高价氧化化物的水化物依次为Al(OH)3、H2SiO3、H2SO4,R的最高价氧化化物的水化物为HNO3,其中H2SiO3和H2SO4都不能和HNO3反应,故D错误;
答案选D。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.乳酸薄荷醇酯![]() 仅能发生水解、氧化、消去反应
仅能发生水解、氧化、消去反应
B.乙醛和丙烯醛![]() 不是同系物,但它们与氢气充分反应后的产物是同系物
不是同系物,但它们与氢气充分反应后的产物是同系物
C.蔗糖和麦芽糖在酸催化下完全水解后的产物都是葡萄糖
D.CH3COOCH2CH3与CH3CH2COOCH3互为同分异构体,1H-NMR谱显示两者均有三种不同的氢原子且三种氢原子的比例相同,故不能用1H-NMR来鉴别
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在标准状况下,下列四种气体的关系中,从大到小的是
①6.72L CH4 ②3.01×1023个HCl分子 ③13.6g H2S ④0.2mol NH3
A. 体积:④>①>②>③
B. 密度:②>③>④>①
C. 质量:②>①>③>④
D. 氢原子数:①>②>③>④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近年来我国科学家发现了一系列意义重大的铁系超导材料,其中一类为FeSmAsFO组成的化合物。回答下列问题:
(1)元素As与N同族。预测As的氢化物分子的立体结构为_______,其沸点比NH3的_______(填“高”或“低”),其判断理由是_________________________。
(2)Fe成为阳离子时首先失去______轨道电子,Sm的价层电子排布式为4f66s2,Sm3+的价层电子排布式为______________________。
(3)比较离子半径:F__________O2(填“大于”等于”或“小于”)。
(4)一种四方结构的超导化合物的晶胞结构如图1所示,晶胞中Sm和As原子的投影位置如图2所示。

图中F和O2共同占据晶胞的上下底面位置,若两者的比例依次用x和1x代表,则该化合物的化学式表示为____________,通过测定密度ρ和晶胞参数,可以计算该物质的x值,完成它们关系表达式:ρ=________g·cm3。
以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标,例如图1中原子1的坐标为(![]() ),则原子2和3的坐标分别为__________、__________。
),则原子2和3的坐标分别为__________、__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W为原子序数依次增大的四种短周期主族元素,A、B、C、D、E为上述四种元素中的两种或三种所组成的化合物。已知A的相对分子质量为28,B分子中含有18个电子,五种化合物间的转化关系如图所示。下列说法错误的是( )
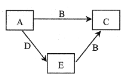
A. X、Y组成化合物的沸点一定比X、Z组成化合物的沸点低
B. Y的最高价氧化物的水化物为弱酸
C. Y、Z组成的分子可能为非极性分子
D. W是所在周期中原子半径最小的元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】地球上的海水中蕴藏了大约40万亿吨氘。从1升海水里提取的氘,在聚变反应中所释放的能量,相当于燃烧300升汽油。如果把自然界的氘和氚全部用于聚变反应,释放出来的能量足够人类使用100亿年。与核裂变相比,氘和氚的聚变能是一种安全、不产生放射性物质、原料成本低廉的能源。同温同压下有等质量的H2、D2、T2三种气体,下列叙述正确的是
①密度之比为1∶2∶3 ②质子数之比为6∶3∶2 ③中子数之比为0∶6∶8 ④体积之比为6∶3∶2
A.①②③④B.只有①②C.只有③④D.只有②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于外围电子层排布为3s23p4的粒子的描述,正确的是( )
A.它的元素符号为O
B.它的核外电子排布式为1s22s22p63s23p4
C.它可与H2生成液态化合物
D.其轨道表示式为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校化学兴趣小组的同学用滴定法对一含有少量Na2SO4的NaOH样品中NaOH的含量进行测定,回答下列问题:
(1)用分析天平准确称取该样品5.0g,全部溶于水配制成1000.0mL的溶液。用____(填一仪器名称)量取其中20.00mL放在锥形瓶中,滴加几滴指示剂,待测。该中和滴定中可选用的指示剂是__________________________,(如有几种,可任填一种)滴定终点的现象是___________________________________________________________。
(2)用0.10mol/L的盐酸溶液滴定未知浓度的NaOH溶液,实验数据如下表所示,
实验编号 | 待测NaOH溶液的体积/mL | HCl溶液的体积/mL |
1 | 20.00 | 24.01 |
2 | 20.00 | 23.99 |
3 | 20.00 | 22.10 |
计算样品中,NaOH的质量百分含量为__________________。
(3)若滴定前,滴定管尖端有气泡,滴定终了气泡消失,将使所测结果______(填“偏高”、“偏低”或“不变”,下同),若读酸式滴定管读数时,滴定前仰视读数,滴定后正确读数,则所测结果_______;
(4)下图为0.10mol/L 25 mL NaOH溶液中逐滴滴加0.10mol/L CH3COOH溶液过程中溶液pH的变化曲线,请回答:
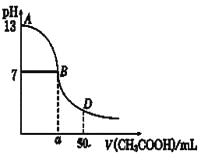
①B点溶液呈中性,有人据此认为,在B点时NaOH与CH3COOH恰好完全反应,这种看法是否正确?______(选填“是”或“否”)。若不正确,则二者恰好完全反应的点是在AB区间还是BD区间内?________区间。(若正确,此问不答)。
②在D点时,溶液中c(CH3COO-)+c(CH3COOH)______2c(Na+)。(填“>”、“<”或“=”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知断裂1molH2(g)中的H—H键需要吸收436kJ能量,断裂1molI2(g)中的I—I键需要吸收151kJ能量,生成1molHI(g)中的H—I键能放出299kJ能量。下列说法正确的是( )
A.1molH2(g)和1molI2(g)的总能量为587kJ
B.H2(g)+I2(s)![]() 2HI(g) ΔH=-11kJ·mol-1
2HI(g) ΔH=-11kJ·mol-1
C.HI(g)![]()
![]() H2(g)+
H2(g)+![]() I2(g) ΔH=+5.5kJmol-1
I2(g) ΔH=+5.5kJmol-1
D.I2(g)比H2分子稳定
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com