
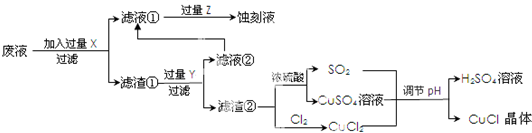
| A、溶解CuSO4?5H2O晶体时要加入少量稀H2SO4 |
| B、加入H2O2,将Fe2+氧化:2Fe2++H2O2+2H+═2Fe3++2H2O |
| C、由于CuSO4的催化作用,会使部分H2O2分解而损失 |
| D、调溶液pH=4的依据是Cu(OH)2比Fe(OH)3更难溶 |


 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案科目:高中化学 来源: 题型:
| 1 | 2 | 3 | |
| 0.25克样品消耗硫酸铈标准溶液的体积(ml) | 24.35 | 24.05 | 23.95 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、溶解→加适量BaCl2溶液→过滤 |
| B、溶解→加适量CaCl2溶液→过滤 |
| C、溶解→加适量Ca(OH)2溶液→过滤 |
| D、溶解→加适量盐酸→加热 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 序号 | X | Y | Z | W | 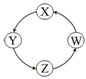 |
| ① | Cu | CuSO4 | Cu(OH)2 | CuO | |
| ② | Na | NaOH | Na2CO3 | NaCl | |
| ③ | Cl2 | Ca(ClO)2 | HClO | HCl | |
| ④ | Fe | FeCl3 | FeCl2 | Fe(OH)2 |
| A、①②③ | B、①③④ |
| C、②③ | D、①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、(NH4)2Fe(SO4)2溶液:c(SO42-)>c(NH4+)>c(Fe2+)>c(H+) |
| B、NH4Cl溶液:c(Cl-)>c(NH4+)>c(OH-)>c(H+) |
| C、Na2CO3溶液:c(Na+)+c(H+)=c(CO32-)+c(HCO3-)+c(OH-) |
| D、NaHCO3溶液:c(Na+)+c(H+)+c(H2CO3)=c(OH-)+c(CO32-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com