
����Ŀ�������¶��£��������ݻ���Ϊ2.0L�ĺ����ܱ������з�����Ӧ��2NO(g)+2CO(g)![]() N2(g)+2CO2(g)����������ʼ���ʵ���Ũ���뷴Ӧ�¶����±���ʾ����Ӧ�����мס���������CO2�����ʵ������仯��ϵ��ͼ��ʾ��
N2(g)+2CO2(g)����������ʼ���ʵ���Ũ���뷴Ӧ�¶����±���ʾ����Ӧ�����мס���������CO2�����ʵ������仯��ϵ��ͼ��ʾ��
���� | �¶�/�� | ��ʼ���ʵ���Ũ��/mol��L-1 | ||||
NO(g) | CO(g) | N2 | CO2 | |||
�� | T1 | 0.10 | 0.10 | 0 | 0 | |
�� | T2 | 0 | 0 | 0.10 | 0.20 | |
�� | T2 | 0.10 | 0.10 | 0 | 0 | |

����˵����ȷ���ǣ� ��
A.�÷�Ӧ������ӦΪ���ȷ�Ӧ
B.�������з�Ӧ�ﵽƽ��ʱ��N2��ת����С��40%
C.�ﵽƽ��ʱ���������е�ѹǿһ�����ڼ�������2��
D.�������з�Ӧ�ﵽƽ����ٳ���0.10molNO��0.10molCO2����ʱv(��)<v(��)
���𰸡�B
��������
A. ����ͼʾ����Ӧ���ʿ죬![]() �������¶ȣ�CO2�����ʵ������٣����Ը÷�Ӧ������ӦΪ���ȷ�Ӧ����A����
�������¶ȣ�CO2�����ʵ������٣����Ը÷�Ӧ������ӦΪ���ȷ�Ӧ����A����
B. ���дﵽƽ��״̬ʱ������̼Ϊ0.12mol��
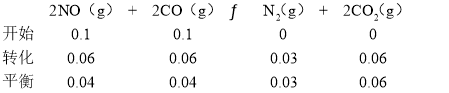
������һ�ߵ�ԭ�������������൱�ڼ���0.20molNO��0.20molCO��Ͷ���DZ���2���������ȣ��൱�ڼ�ѹ��ƽ�������ƶ�����������N2��ƽ��Ũ�ȴ���0.06 mol/L������N2��ת����С��40%����B��ȷ��
C. ������һ�ߵ�ԭ�������������൱�ڼ���0.20mol NO��0.20mol CO��Ͷ�ϵ����ʵ����Ǽ�2������ѹǿ��ƽ��������У��������ʵ�����С�����¶ȱ��Ҹߣ������������е�ѹǿһ��С�ڼ�������2������C����
D. 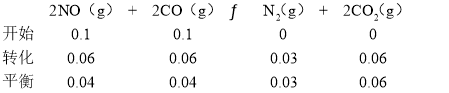
![]() ���������з�Ӧ�ﵽƽ����ٳ���0.10molNO��0.10molCO2��
���������з�Ӧ�ﵽƽ����ٳ���0.10molNO��0.10molCO2�� ��ƽ��������У�����v(��)>v(��)����D����
��ƽ��������У�����v(��)>v(��)����D����



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ȼ�����(SOCl2)�ڿ��к�ҵ��Ӧ�ñȽϹ㷺���ش��������⣺
I����ҵ������β��SO2��SCl2��C12��Ӧ�ϳ��Ȼ��������������·�Ӧ��
��C12(g)+SO2(g)![]() SO2C12(g) ��H=-471.7kJ��mol-1
SO2C12(g) ��H=-471.7kJ��mol-1
��SO2C12(g)+SCl2(g)![]() 2SOC12(g)��H=-5.6kJ��mol-1
2SOC12(g)��H=-5.6kJ��mol-1
567Kʱ����10L�ܱ������У�����һ������C12��SO2��SCl2����ó�ʼѹǿΪp0����Ӧ��������������ѹǿ(p)��ʱ��(t)�仯(��Ӧ�ﵽƽ��ʱ���¶����ʼ�¶���ͬ)����ͼ��ʾ����ʼ����ּ���ƽ��ʱSO2C12(g)�����ʵ������±���

(1)0~1min��ͼ��������ʾ��ϵѹǿ�����ԭ����________________��
(2)0~4min�ڣ�v(C12)=_____mol��L-1��min-1��5minʱSCl2��ת����Ϊ________��
(3)567Kʱ��������Ӧ�ڵ�KP______��
(4)567K�£��������������Ϊ20L����ƽ��ʱc(SO2)_____(����ڡ���С�ڡ����ڡ�)������Ӧƽ��ʱ��c(SO2)��
II��Li��SOCl2�����һ�ָ߱�������أ����ҺΪ��ˮ��LiAlC14��SOCl2��Һ������Ϊ����̪ݼ�����(M-Pe�������������)���ŵ�̼��������������Ϊ��SOCl2����̪ݼ�γɼӺ�����ŷ����Ӻ�����������ٵĵ���ת�ƣ�������ͼ��ʾ��

(5)��������������M-PeSOCl2Ϊ_______(����������м���)���ŵ������ÿת��1mol��������_____g���ʡ�����ܷ�Ӧ�Ļ�ѧ����ʽΪ_______________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij����С��ֱ�����ͼ��ʾװ�ö�ԭ��غ͵��ԭ������ʵ��̽����

��ش�
����ͼ 1 ��ʾװ�ý��е�һ��ʵ�顣
��1���ڱ�֤�缫��Ӧ���������£�������� Cu ���缫����__������ĸ��ţ���
A �� B ʯī C �� D ��
��2��N ��������Ӧ�ĵ缫��ӦʽΪ__��
����ͼ 2 ��ʾװ�ý��еڶ���ʵ�顣ʵ������У��۲쵽���һ��ʵ�鲻ͬ�����������������������Y������Һ����Ϻ�ɫ��ֹͣʵ�飬���缫���Ա�ϸ�����Һ��Ȼ���塣 �������ϵ�֪������������ӣ�FeO42-������Һ�г��Ϻ�ɫ��
��3���������У�X ������Һ�� pH__����������������С����������������
��4���������У�Y �������ĵ缫��Ӧ֮һΪ Fe��6e��+8OH��= FeO42-+4H2O ���� X ���ռ���672 mL ���壬�� Y ���ռ��� 168 mL ���壨��������Ϊ��״��ʱ������������� Y �缫�����缫����������____g��
��5���ڼ���п����У��ø��������Ϊ�������ϣ���ط�ӦΪ 2K2FeO4+3Z=Fe2O3+ZnO+2K2ZnO2���õ�����������ķ�Ӧ�ĵ缫��ӦʽΪ__��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ�������о����ض���ȼ�ϵ�أ���ҺҲ�ܷ��硣�����ֵ��ֱ��ȥ�����з�ˮ�е����أ����ܲ���������ˮ�����ܷ��磬����ȼ�ϵ�ؽṹ��ͼ��ʾ�������й�������ȷ����(����)

A. ��ع���ʱH������
B. �õ���õĵ������Һ��KOH��Һ
C. �缫��Ӧʽ��CO(NH2)2��H2O��6e����CO2��N2��6H��
D. ��ع���ʱ��������ÿ����1 mol CO(NH2)2������33.6 L O2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������Ҫ����Ԥ��ͬ������������ų���Ӧ����ṹ��ʽ����ͼ��ʾ��

����˵����ȷ����
A. ���������ķ���ʽΪC23H30O7N
B. ���������ɷ����ӳɡ�ȡ������ȥ��Ӧ
C. ������������������̼ԭ��һ������ͬһƽ��
D. 1mol����������NaOH��Һ��ַ�Ӧ�������3mol NaOH��Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����淴Ӧ2A(g)+3B(g)![]() 4C(g)+D(g)�� ��֪��ʼŨ��c(A)=4 mol��L-1��c(B)=3 mol��L-1��C��DŨ�Ⱦ�����0����Ӧ��ʼ2 ���ﵽƽ��״̬����ʱD ��ƽ��Ũ��Ϊ0.5 mol��L-1,������˵������ȷ����( )
4C(g)+D(g)�� ��֪��ʼŨ��c(A)=4 mol��L-1��c(B)=3 mol��L-1��C��DŨ�Ⱦ�����0����Ӧ��ʼ2 ���ﵽƽ��״̬����ʱD ��ƽ��Ũ��Ϊ0.5 mol��L-1,������˵������ȷ����( )
A. ��Ӧ����v(C)= 1mol/��L��s�� B. C��ƽ��Ũ��Ϊ4mol /L
C. A��ת����Ϊ25% D. B��ƽ��Ũ��Ϊ1.5mol /L
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����( ���� )
A. �����ʡ���ά�ء����ǡ�![]() �����۶��Ǹ߷��ӻ�����
�����۶��Ǹ߷��ӻ�����
B. ������������ˮ��IJ���ֻ��������
C. ʹ��̫������ˮ�������������á��������Ҵ����漰���������ܵ�����
D. ʯ�͡�ú����Ȼ������ȼ�����ǻ�ʯȼ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������һ�ֳ���ˮ����������ʳ���������Ѹɣ�����֮�⣬���ѻ���������ơ�
(1)��������֭���������ǵķ����ǣ������мӼ�������ԣ��ټ������Ƶ�Cu(OH)2�����ȣ���������________��
(2)��������ƹ����У�������ת��Ϊ�ƾ��Ĺ������£�����������л�ѧ����ʽ��C6H12O6(������)![]() 2_________+ 2 C2H5OH
2_________+ 2 C2H5OH
(3)���Ѿ��ܷⴢ������л���������ζ�����࣬����Ҳ����ͨ����ѧʵ�����Ʊ���ʵ���ҿ�����ͼ��ʾװ���Ʊ�����������

���Թ�a���������������Ļ�ѧ����ʽ��__________��
���Թ�b��ʢ�ŵ��Լ��DZ���____________��Һ��
��ʵ�鿪ʼʱ���Թ�b�еĵ��ܲ�����Һ���µ�ԭ����________��
����Ҫ������Թ�b�е�������������Ҫ�õ���������_______(����ĸ)��
A.��ͨ©�� B.��Һ©�� C.����©��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Q��R��X��Y��ZΪ���ڱ���ԭ���������ε�����ǰ������Ԫ�ء�
��֪����QΪԪ�����ڱ���ԭ�Ӱ뾶��С��Ԫ�أ���R�Ļ�̬ԭ���е���ռ������������ͬ���ܼ�����ÿ���ܼ��еĵ���������ͬ����Y�Ļ�̬ԭ�ӵĺ���ɶԵĵ�������δ�ɶԵĵ�������3������Z��̬ԭ��������δ�ɶԵ��ӡ��ö�Ӧ��Ԫ�ط��Ż�ѧʽ�ش��������⣺
(1)R��X��Y�ĵ�һ�������ɴ�С��˳��Ϊ____________________��
(2)QԪ����Ԫ�����ڱ�������____������YԪ��ͬ��ĵ�������Ԫ�صļ۵����Ų�ʽΪ______��
(3)RY2�ĵ���ʽΪ________________��Z3+�����ӽṹʾ��ͼΪ____________��
(4) ��Y��Z����Ԫ����ɵ�Z2Y72�����������������¿����Ҵ���Ӧ���������ᡢZ3+�����ʡ��÷�Ӧ�����ӷ���ʽΪ______��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com