
【题目】Q、R、X、Y、Z为周期表中原子序数依次递增的前四周期元素。
已知:①Q为元素周期表中原子半径最小的元素;②R的基态原子中电子占据三种能量不同的能级,且每种能级中的电子总数相同;③Y的基态原子的核外成对的电子数是未成对的电子数的3倍;④Z基态原子有六个未成对电子。用对应的元素符号或化学式回答下列问题:
(1)R、X、Y的第一电离能由大到小的顺序为____________________。
(2)Q元素在元素周期表中属于____区,与Y元素同族的第四周期元素的价电子排布式为______。
(3)RY2的电子式为________________,Z3+的离子结构示意图为____________。
(4) 由Y、Z两种元素组成的Z2Y72-离子在酸性条件下可与乙醇反应,生成乙酸、Z3+等物质。该反应的离子方程式为______。
【答案】N>O>C s 4s24p4 ![]()
 2Cr2O72-+ 3CH3CH2OH+16H+
2Cr2O72-+ 3CH3CH2OH+16H+ ![]() 4Cr3++3CH3COOH+11H2O
4Cr3++3CH3COOH+11H2O
【解析】
Q、R、X、Y、Z为周期表中原子序数依次递增的前四周期元素,①Q为元素周期表中原子半径最小的元素,则Q为H元素;②R的基态原子中电子占据三种能量不同的能级,说明R原子含有1s、2s、2p能级,且每种能级中的电子总数相同,则R元素的原子序数是6,为C元素;③Y的基态原子的核外成对电子数是未成对电子数的3倍,核外电子排布式为1s22s22p4,应为O元素;R、X、Y原子序数依次增大,故X为氮;④Z基态原子有六个未成对电子,故其电子排布为:[Ar]3d64s2,Z的原子序数是24,所以Z为Cr元素,综上可知Q为氢元素、R为碳元素、X为氮元素、Y为氧元素、Z为铬元素。
(1)C、N、O的第一电离取决于元素非金属性的强弱,但是由于N的2p能级上电子处于半充满的相对稳定状态,故C、N、O的第一电离能由大到小的顺序为N>O>C,故答案为:N>O>C;
(2)Q元素为H,H在元素周期表中属于第一周期第ⅠA族,即s区;Y为O元素,与O元素同族(最外层电子数为6)的第四周期元素的价电子排布式为为4s24p4,故答案为:s;4s24p4;
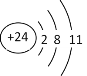
(3)RY2为CO2,二氧化碳中,C与O形成两对共用电子对,故电子式为:![]() ;Z3+为Cr3+,Cr3+的离子结构示意图为:
;Z3+为Cr3+,Cr3+的离子结构示意图为: ,故答案为:
,故答案为:![]() ;
; ;
;
(4)O、Cr两种元素组成的离子为Cr2O72-,Cr2O72-在酸性条件下具有强氧化性,可将乙醇直接氧化为反应乙酸,本身被还原为Cr3+,反应的离子方程式为2Cr2O72-+3CH3CH2OH+16H+→4Cr3++3CH3COOH+11H2O,故答案为:2Cr2O72-+3CH3CH2OH+16H+→4Cr3++3CH3COOH+11H2O。


科目:高中化学 来源: 题型:
【题目】现有m g某气体,它由双原子分子构成,它的摩尔质量为M g/mol.若阿伏加德罗常数的值用NA表示,则:
(1)该气体的物质的量为______mol.
(2)该气体所含原子总数为______个.
(3)该气体在标准状况下的体积为______L.
(4)该气体溶于1L水中(不考虑反应),形成的溶液溶质的质量分数为______.
(5)该气体溶于水形成VL溶液,其溶液的物质的量浓度为______mol/L.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生需要用烧碱固体配制0.5mol·L-1的NaOH溶液480mL。实验室提供以下仪器:
①100mL烧杯 ②100mL量筒 ③1000mL容量瓶 ④500mL容量瓶 ⑤玻璃棒 ⑥托盘天平(带砝码) ⑦药匙。请回答下列问题:
(1)计算需要称取NaOH固体_________g。
(2)配制时,必须使用的仪器有_______(填代号),还缺了仪器名称是_________。
(3)配制时,其正确的操作顺序是(字母表示,每个操作只用一次)________。
A.用少量水洗涤烧杯2~3次,洗涤液均注入容量瓶,振荡
B.在盛有NaOH固体的烧杯中加入适量水溶解
C.将烧杯中已冷却的溶液沿玻璃棒注入容量瓶中
D.将容量瓶盖紧,反复上下颠倒,摇匀
E.改用胶头滴管加水,使溶液凹面恰好与刻度相切
F.继续往容量瓶内小心加水,直到液面接近刻度1~2cm处
(4)若出现如下情况,其中将引起所配溶液浓度偏高的是___。(填下列编号)
①容量瓶实验前用蒸馏水洗干净,但未烘干 ②定容观察液面时俯视
③配制过程中遗漏了(3)中步骤A ④加蒸馏水时不慎超过了刻度
⑤未等NaOH溶液冷却至室温就转移到容量瓶中
(5)用配制好的溶液,再来配制50ml0.2mol·Lˉ1的NaOH溶液,需要取原配好的溶液_____ml。
查看答案和解析>>
科目:高中化学 来源: 题型:
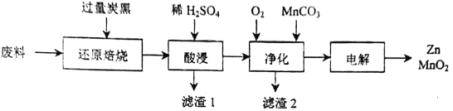
【题目】废旧电池的回收处理,既能减少对环境的污染,又能实现资源的再生利用。将废旧锌锰电池初步处理后,所得废料含MnO2、MnOOH、Zn(OH)2及少量Fe等,用该废料制备Zn和MnO2的一种工艺流程如下:
已知:
①Mn2+在酸性条件下比较稳定,pH高于5.5时易被O2氧化
②有关Ksp数据如下表所示
化合物 | Mn(OH)2 | Zn(OH)2 | Fe(OH)3 |
Ksp近似值 | 10-13 | 10-17 | 10-38 |
回答下列问题:
(1)还原焙烧过程中, MnOOH与炭黑反应,锰元素被还原为MnO,该反应的化学方程式为___________。传统的工艺是使用浓盐酸在加热条件下直接处理废料,缺点是___________。
(2)酸漫时一般会适当加热并不断搅拌,其作用是___________,滤渣1和滤渣2主要成分的化学式依次是___________。
(3)净化时,先通入O2再加入MnCO3,其目的是___________;已知净化时溶液中Mn2+、Zn2+的浓度约为0.1mol·L-1,调节pH的合理范围是___________。
(4)电解制取MnO2时,MnO2在___________极产生。
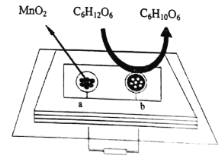
(5)中科院研究人员将MnO2和生物质置于一个由滤纸制成的折纸通道内形成电池,该电池可将软饮料中的葡萄糖作为燃料获得能量,装置如图所示。此装置中b极的电极反应式为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
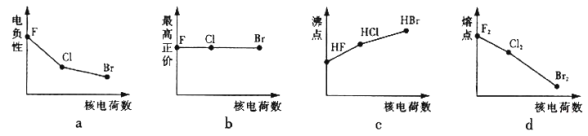
【题目】卤族元素包括F、Cl、Br等元素。
(1)下列曲线表示卤族元素某种性质随核电荷数的变化趋势,正确的是_______。
(2)在测定HF的相对分子质量时,实验测定值一般高于理论值的主要原因是______________。
(3)BCl3和NCl3中心原子的杂化方式是否相同_____________(填 是 或 否)。第一电离能介于B、N之间的第二周期元素有_______种。
(4)铑(Rh)与碘属于同周期元素。铑的某配合物的化学式为CsRh(SO4)2,该物质易溶于水,向其水溶液中加入一定浓度的BaCl2溶液,无沉淀生成,该盐溶于水的电离方程式为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为长式周期表的一部分,其中的编号代表对应的元素。
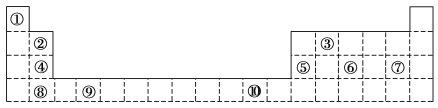
请回答下列问题:
(1)表中属于d区元素的是________(填元素符号)。
(2)表中元素①的6个原子与元素③的6个原子形成的某种环状分子名称为____;③和⑦形成的一种常见溶剂的化学式为_____。
(3)元素④的第一电离能________元素⑤(选填“>”、“=”或“<”)的第一电离能;元素⑥的电负性________元素⑦(选填“>”、“=”或“<”)的电负性。
(4)元素⑦和⑧形成的化合物的电子式为________________。
(5)某些不同族元素的性质也有一定的相似性,如上表中元素②与元素⑤的氢氧化物有相似的性质。请写出元素②的氢氧化物与NaOH溶液反应的化学方程式:________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有X、Y、Z三种元素,已知:①X、Y、Z的单质在常温下均为气体;②X单质可在Z单质中燃烧,生成XZ,火焰为苍白色;③XZ极易溶于水,其水溶液可使蓝色石蕊试纸变红;④每2个X2分子可与1个Y2分子化合生成2个X2Y分子,X2Y在常温下为液体;⑤Z单质溶于X2Y中,所得溶液具有漂白作用;⑥细铁丝能在Z2(g)中剧烈燃烧,且产生红棕色烟。推断:
(1)X、Y两种元素的名称X___,Y___。
(2)化合物的化学式:XZ___,X2Y___。
(3)过程⑥中涉及的化学反应方程式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对![]() 的性质进行探究,设计了以下实验
的性质进行探究,设计了以下实验

已知:![]() 、
、![]() 、
、![]() 等称之为拟卤素,它们的化学性质均与卤素单质相似。下列说法正确的是
等称之为拟卤素,它们的化学性质均与卤素单质相似。下列说法正确的是
A.溶液颜色变红时发生反应的离子方程式是:![]()
B.红色溶液褪色表现了![]() 的漂白性
的漂白性
C.氧化性:![]()
D.无色溶液Ⅱ中滴入适量的![]() 溶液,溶液又变成红色
溶液,溶液又变成红色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镍、钴、钛、铜等元素常用作制备锂离子电池的正极材料或高效催化剂。NA表示阿伏加德罗常数,请填写下列空白。
(1)基态Co原子的电子排布式为___。
(2)镍与CO生成的配合物Ni(CO)4中,易提供孤电子对的成键原子是___(填元素名称);1 molNi(CO)4中含有的σ键数目为__;写出与CO互为等电子体的一种阴离子的化学式_____。
(3)Ti(BH4)2是一种储氢材料。BH4-的空间构型是____,B原子的杂化方式__。与钛同周期的第ⅡB族和ⅢA族两种元素中第一电离能较大的是___(写元素符号),原因是____。
(4)CuFeS2的晶胞如图所示,晶胞参数分别为anm、bnm、cnm;CuFeS2的晶胞中每个Cu原子与___个S原子相连,晶体密度ρ=___g·cm3(列出计算表达式)。

以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标,例如图中原子2和3的坐标分别为(0,1,![]() )、(
)、(![]() ,
,![]() ,0),则原子1的坐标为___。
,0),则原子1的坐标为___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com