
【题目】卤族元素包括F、Cl、Br等元素。
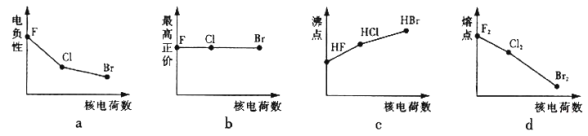
(1)下列曲线表示卤族元素某种性质随核电荷数的变化趋势,正确的是_______。
(2)在测定HF的相对分子质量时,实验测定值一般高于理论值的主要原因是______________。
(3)BCl3和NCl3中心原子的杂化方式是否相同_____________(填 是 或 否)。第一电离能介于B、N之间的第二周期元素有_______种。
(4)铑(Rh)与碘属于同周期元素。铑的某配合物的化学式为CsRh(SO4)2,该物质易溶于水,向其水溶液中加入一定浓度的BaCl2溶液,无沉淀生成,该盐溶于水的电离方程式为___________。
【答案】a HF分子间通过氢键形成缔合分子 否 3 CsRh(SO4)2=Cs++[Rh(SO4)2]-
【解析】
(1)a、卤族元素非金属性越强,电负性越大,卤族元素非金属性随着原子序数增大而增大,所以电负性随着原子序数增大而增大,故正确;
b、F元素没有正化合价,其它卤族元素最高正价为+7价,故错误;
c、卤族元素氢化物沸点随着原子序数增大而增大,但含有氢键的卤化氢沸点最高,HF分子间存在氢键,所以沸点最高,故错误;
d、卤族元素单质的熔点随着原子序数增大而增大,故错误;
故答案为:a;
(2)HF分子之间存在氢键,形成缔合(HF)n分子,故实验测得HF的相对分子质量的值一般高于理论值,故答案为:HF分子间通过氢键形成缔合分子;
(3)BCl3分子中B原子价层电子对数为3,不含孤电子对,所以B原子采用sp2杂化;NCl3中N原子价层电子对个数为4,含有一个孤电子对,所以N原子的杂化方式为sp3,两者杂化方式不同;同一周期元素中,元素第一电离能随着原子序数的增大而呈增大趋势,但第IIA族、第VA族元素第一电离能大于相邻元素,所以第一电离能介于B、N之间的第二周期元素有Be、C、O两种元素,故答案为:否;3;
(4)铑的某配合物的化学式为CsRh(SO4)24H2O,该物质易溶于水,向其水溶液中加入一定浓度的BaCl2溶液,无沉淀生成,说明硫酸根处于内界,该盐溶于水的电离方程式为:CsRh(SO4)24H2O=Cs++[Rh(SO4)2]-+4H2O,故答案为:CsRh(SO4)24H2O=Cs++[Rh(SO4)2]-+4H2O。


科目:高中化学 来源: 题型:
【题目】下列关于焓变(ΔH)的叙述或判断中错误的是

A. 2NO(g)+2CO(g)=N2(g)+2CO2(g)在常温下能自发进行,则该反应的 ΔH<0
B. 500 ℃、30 MPa下,0.5 mol N2和1.5 mol H2充分反应放出 19.3 kJ 热量,则反应“N2(g)+3H2(g) ![]() 2NH3(g)”的 ΔH=-38.6 kJ·mol-1
2NH3(g)”的 ΔH=-38.6 kJ·mol-1
C. 据下图1 知:ΔH1 = ΔH2+ΔH3
D. 据下图2 知:E的大小对该反应的ΔH 无影响
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯环结构中,不存在碳碳单键和碳碳双键的简单交替结构,可以作为证据的事实是( )
①苯不能使酸性KMnO4溶液褪色
②苯分子中碳碳键的长度完全相等
③苯能在加热和催化剂存在的条件下与氢气发生反应生成环己烷(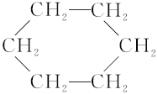 )
)
④经实验测得对二甲苯(![]() )只有一种结构
)只有一种结构
⑤苯在溴化铁作催化剂条件下同液溴可发生取代反应,但不能因化学反应而使溴水褪色
A. ②③④B. ②④⑤C. ①③⑤D. ①②⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A. 氨分子是三角锥形,而甲烷是正四面体形,是因为NH3分子中有一对未成键的孤电子对,它对成键电子的排斥作用较强
B. 杂化轨道全部参加形成化学键
C. PCl5分子中P原子和Cl原子最外层都满足8电子结构
D. 在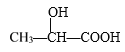 分子中含有2个手性C原子
分子中含有2个手性C原子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向盛有硫酸铜水溶液的试管里加入氨水,首先形成难溶物,继续加氨水,难溶物溶解,得到深蓝色溶液。
I.在化学实验和科学研究中,水是一种最常用的溶剂。水是生命之源,它与我们的生活密切相关。(1)写出与H2O分子互为等电子体的微粒:_________(填1种)。
(2)水分子在特定条件下容易得到一个H+,形成水合氢离子(H3O+ )。下列对上述过程的描述不合理的是____(填字母序号)。
A.氧原子的杂化类型发生了改变 B.微粒子的形状发生了改变
C.微粒的化学性质发生了改变 D.微粒中的键角发生了改变
II. Cu2+可形成多种配合物,广泛应用于生产生活中。
(3) 实验时将白色粉末无水CuSO4溶解于水中,溶液呈蓝色,是因为生成了一种呈蓝色的配离子。请写出该配离子的化学式 :______。向该蓝色溶液中滴加氨水,先形成难溶物,继续加氨水,难溶物溶解,写出溶解过程的离子方程式:________。溶解后得到深蓝色溶液,向溶液加入乙醇,会析出深蓝色晶体,该晶体的化学式为_________ 。
(4)Cu2+可以与乙二胺(H2N﹣CH2CH2﹣NH2)形成配离子(如图)
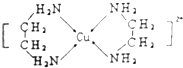
①H、O、N三种元素的电负性从大到小的顺序_______________________.
②乙二胺沸点高于Cl﹣CH2CH2﹣Cl的主要原因是_________________________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Q、R、X、Y、Z为周期表中原子序数依次递增的前四周期元素。
已知:①Q为元素周期表中原子半径最小的元素;②R的基态原子中电子占据三种能量不同的能级,且每种能级中的电子总数相同;③Y的基态原子的核外成对的电子数是未成对的电子数的3倍;④Z基态原子有六个未成对电子。用对应的元素符号或化学式回答下列问题:
(1)R、X、Y的第一电离能由大到小的顺序为____________________。
(2)Q元素在元素周期表中属于____区,与Y元素同族的第四周期元素的价电子排布式为______。
(3)RY2的电子式为________________,Z3+的离子结构示意图为____________。
(4) 由Y、Z两种元素组成的Z2Y72-离子在酸性条件下可与乙醇反应,生成乙酸、Z3+等物质。该反应的离子方程式为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W、X、Y、Z是周期表前36号元素中的四种常见元素,其原子序数依次增大。W、Y的氧化物是导致酸雨的主要物质,X的基态原子的核外有7个原子轨道填充了电子,Z能形成红色(或砖红色)的Z2O和黑色的ZO两种氧化物。
(1)W位于元素周期表第_____周期第____族。W的气态氢化物稳定性比H2O(g)_______(填“强”或“弱”)。
(2)Y的基态原子的核外电子排布式是______, Y的第一电离能比X的________(填“大”或“小”)。
(3)Y的最高价氧化物对应水化物的浓溶液与Z的单质反应的化学方程式是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D四种无机物具有如图所示的转化关系(反应条件及反应中的水均略去),且A、B、C含有同一种元素。下列说法错误的是
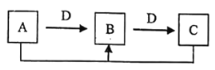
A.若A的溶液显碱性,则D可能是单质
B.A与C的反应可能是非氧化还原反应
C.A或D可能是目前使用最广泛的金属单质
D.若C是能使澄清石灰水变浑浊的气体,则A一定是单质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究减少CO2排放是一项重要课题。CO2经催化加氢可以生成低碳有机物,主要有以下反应:
反应Ⅰ:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H1=-49.6 kJ/mol
CH3OH(g)+H2O(g) △H1=-49.6 kJ/mol
反应Ⅱ:CH3OCH3(g)+H2O(g)![]() 2CH3OH(g) △H2=+23.4 kJ/mol
2CH3OH(g) △H2=+23.4 kJ/mol
反应Ⅲ:2CO2(g)+6H2(g)![]() CH3OCH3(g)+3H2O(g) △H3
CH3OCH3(g)+3H2O(g) △H3
(1)△H3=____kJ/mol。
(2)恒温恒容条件下,在密闭容器中通入等物质的量的CO2和H2,发生反应I。下列描述能说明反应I达到平衡状态的是___(填序号)。
A.反应体系总压强保持不变
B.容器内的混合气体的密度保持不变
C.水分子中断裂2NA个H-O键,同时氢分子中断裂3NA个H-H键
D.CH3OH和H2O的浓度之比保持不变
(3)反应II在某温度下的平衡常数为0.25,此温度下,在密闭容器中加入等物质的量的CH3OCH3(g)和H2O(g),反应到某时刻测得各组分浓度如下:
物质 | CH3OCH3(g) | H2O(g) | CH3OH(g) |
浓度/mol·L-1 | 1.8 | 1.8 | 0.4 |
此时v正___v逆(填“>”、“<”或“=”),当反应达到平衡状态时,混合气体中CH3OH体积分数(CH3OH)% =___%。
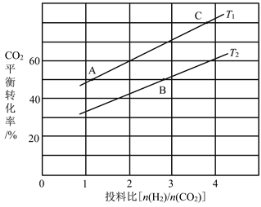
(4)在某压强下,反应III在不同温度、不同投料比时,CO2的平衡转化率如图所示。T1温度下,将6mol CO2和12mol H2充入2 L的密闭容器中,5min后反应达到平衡状态,则0~5min内的平均反应速率v(CH3OCH3)=____;KA、KB、KC三者之间的大小关系为____。
(5)恒压下将CO2和H2按体积比1:3混合,在不同催化剂作用下发生反应I和反应III,在相同的时间段内CH3OH的选择性和产率随温度的变化如图。其中:CH3OH的选择性=![]() ×100%
×100%
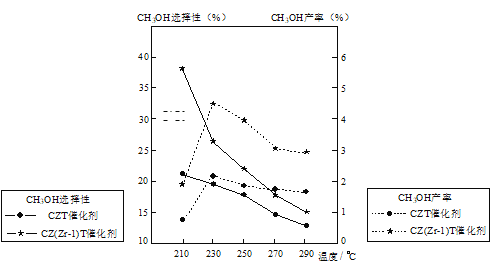
①温度高于230℃,CH3OH产率随温度升高而下降的原因是_____。
②在上述条件下合成甲醇的工业条件是____。
p>A.210℃ B.230℃ C.催化剂CZT D.催化剂CZ(Zr-1)T查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com