
����Ŀ���о�����CO2�ŷ���һ����Ҫ���⡣CO2��������������ɵ�̼�л����Ҫ�����·�Ӧ��
��Ӧ��CO2(g)��3H2(g)![]() CH3OH(g)��H2O(g) ��H1����49.6 kJ/mol
CH3OH(g)��H2O(g) ��H1����49.6 kJ/mol
��Ӧ��CH3OCH3(g)��H2O(g)![]() 2CH3OH(g) ��H2����23.4 kJ/mol
2CH3OH(g) ��H2����23.4 kJ/mol
��Ӧ��2CO2(g)��6H2(g)![]() CH3OCH3(g)��3H2O(g) ��H3
CH3OCH3(g)��3H2O(g) ��H3
��1����H3��____kJ/mol��
��2�����º��������£����ܱ�������ͨ������ʵ�����CO2��H2��������ӦI������������˵����ӦI�ﵽƽ��״̬����___������ţ���
A����Ӧ��ϵ��ѹǿ���ֲ���
B�������ڵĻ��������ܶȱ��ֲ���
C��ˮ�����ж���2NA��H-O����ͬʱ������ж���3NA��H-H��
D��CH3OH��H2O��Ũ��֮�ȱ��ֲ���
��3����ӦII��ij�¶��µ�ƽ�ⳣ��Ϊ0.25�����¶��£����ܱ������м�������ʵ�����CH3OCH3(g)��H2O(g)����Ӧ��ijʱ�̲�ø����Ũ�����£�
���� | CH3OCH3(g) | H2O(g) | CH3OH(g) |
Ũ��/mol��L��1 | 1.8 | 1.8 | 0.4 |
��ʱv��___v������������������������������������Ӧ�ﵽƽ��״̬ʱ�����������CH3OH�������(CH3OH)% ��___%��
��4����ijѹǿ�£���ӦIII�ڲ�ͬ�¶ȡ���ͬͶ�ϱ�ʱ��CO2��ƽ��ת������ͼ��ʾ��T1�¶��£���6mol CO2��12mol H2����2 L���ܱ������У�5min��Ӧ�ﵽƽ��״̬����0��5min�ڵ�ƽ����Ӧ����v(CH3OCH3)��____��KA��KB��KC����֮��Ĵ�С��ϵΪ____��
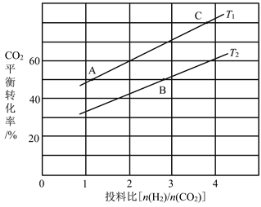
��5����ѹ�½�CO2��H2�������1��3��ϣ��ڲ�ͬ���������·�����ӦI�ͷ�ӦIII������ͬ��ʱ�����CH3OH��ѡ���ԺͲ������¶ȵı仯��ͼ�����У�CH3OH��ѡ���ԣ�![]() ��100%
��100%
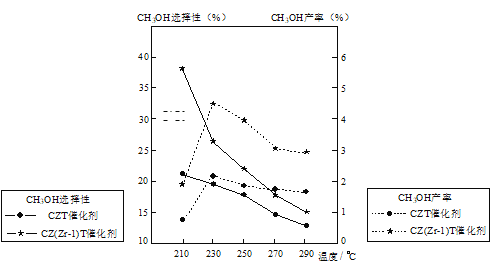
���¶ȸ���230�棬CH3OH�������¶����߶��½���ԭ����_____��
�������������ºϳɼ״��Ĺ�ҵ������____��
p>A��210�� B��230�� C������CZT D������CZ(Zr��1)T���𰸡���122.6 AC �� 20 0.18mol��L1��min1 KA��KC��KB ��ӦI����H��0�¶����ߣ�ʹCO2ת��ΪCH3OH��ƽ��ת�����½� BD
��������
��1�����ݸ�˹�����Լ��Ȼ�ѧ����ʽ���м��㣻
��2�����ݻ�ѧƽ��״̬���жϱ�־�����жϣ�
��3������Ũ���̺ͻ�ѧƽ�ⳣ���Ĵ�С��ϵ�жϷ�Ӧ���еķ�����δ֪�����û�ѧƽ�ⳣ���г�����ʽ�ⷽ�̣������������������
��4������ͼ��ȷ��CO2��ƽ��ת���ʣ���������CH3OCH3���������������û�ѧ��Ӧ���ʵļ��㹫ʽ����v(CH3OCH3)�����ݻ�ѧƽ�ⳣ��ֻ���¶��йأ��¶Ȳ��䣬��ѧƽ�ⳣ�����䣬�ó�KA��KC���ٸ��ݸ÷�ӦΪ������ȵķ�Ӧ������ƽ�������ƶ������ͼ���ж�T1��T2�Ĵ�С��ϵ���Ӷ��ó�KA��KC��KB���ߵĹ�ϵ��
��5����ӦI�ġ�H��0������ƽ�������ƶ���CO2ת��ת���ʽ��ͣ�CH3OH�����½����ٽ��ͼ���жϺϳɼ״��Ĺ�ҵ������
��1�����ݸ�˹����֪����ӦIII=��Ӧ���2-��Ӧ������ˣ���H3=��H1��2-��H2=��49.6 kJ/mol��2-23.4 kJ/mol=-122.6 kJ/mol��
�ʴ�Ϊ����122.6��
��2����Ӧ����Ϊ���º��ݣ���ӦI��CO2(g)��3H2(g)![]() CH3OH(g)��H2O(g)Ϊ��Ӧǰ���������ʵ������ٵķ�Ӧ��
CH3OH(g)��H2O(g)Ϊ��Ӧǰ���������ʵ������ٵķ�Ӧ��
A. �÷�ӦΪ��Ӧǰ���������ʵ������ٵķ�Ӧ�����ŷ�Ӧ�Ľ����������ʵ������٣���ϵ��ѹǿ��С����˵���Ӧ��ϵ��ѹǿ���ֲ���ʱ��˵����ӦI�ﵽƽ��״̬��A����ȷ��
B. ���������غ㶨��֪�����������������䣬�����ݻ�Ҳ���䣬�����ŷ�Ӧ�Ľ��У������ڵĻ��������ܶ�ʼ�ձ��ֲ��䣬��˵��������ڵĻ��������ܶȱ��ֲ���ʱ����˵����ӦI�ﵽƽ��״��B�����
C. ��ˮ�����ж���2NA��H��O��ʱ����3NA��H��H���γɣ�������3mol����ӣ���ͬʱ������ж���3NA��H��H����������3mol����ӣ������������ʵ������ֲ��䣬��Ӧ�ﵽƽ��״̬�����ˮ�����ж���2NA��H��O����ͬʱ������ж���3NA��H��H����˵����ӦI�ﵽƽ��״��C����ȷ��
D. ��Ӧ�ﵽƽ��״̬ʱ�����ʵ����ʵ���Ũ�ȱ��ֲ��䣬��CH3OH��H2O��Ũ��֮��ʼ�յ���1:1�����CH3OH��H2O��Ũ��֮�ȱ��ֲ��䲻��˵����ӦI�ﵽƽ��״��D����ȷ��
�ʴ�Ϊ��AC��
��3���˿̷�Ӧ��Ũ����![]() ����˷�Ӧ������Ӧ������У�v��>v����
����˷�Ӧ������Ӧ������У�v��>v����
����ʼʱCH3OCH3��H2O�����ʵ�����Ϊa mol����Ӧ�ﵽƽ��״̬ʱ��CH3OCH3��ת����Ϊx mol������г�����ʽ��
CH3OCH3(g) �� H2O(g)![]() 2CH3OH(g)
2CH3OH(g)
��ʼ��mol�� a mol a mol 0
ת����mol�� x mol x mol 2x mol
ƽ�⣨mol�� (a-x)mol (a-x)mol 2x mol
��ѧƽ�ⳣ��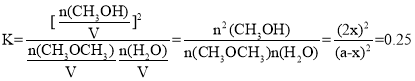 ����ã�x=0.2a������������CH3OH�����ʵ���Ϊ0.4a��������������ʵ���������Ϊ2a����˻��������CH3OH�������
����ã�x=0.2a������������CH3OH�����ʵ���Ϊ0.4a��������������ʵ���������Ϊ2a����˻��������CH3OH�������![]() ��
��
�ʴ�Ϊ������20��
��4����ͼ��֪����T1�¶��£���6 molCO2��12molH2����2 L���ܱ�������ʱ��CO2��ƽ��ת����Ϊ60%�����CO2��ת����Ϊ6 mol��60%=3.6��������CH3OCH3�����ʵ���Ϊ1.8mol��![]() ��
��
��ѧƽ�ⳣ��ֻ���¶��йأ��¶Ȳ��䣬��ѧƽ�ⳣ�����䣬��KA��KC����ͼ���֪����Ͷ�ϱ���ͬʱ��T1�¶��µ�ƽ��ת���ʽϴ÷�ӦΪ������ȵķ�Ӧ������ƽ�������ƶ�����ѧƽ�ⳣ���������T1<T2��KA��KC��KB��
�ʴ�Ϊ��0.18mol��L1��min1��KA��KC��KB��
��5���ٷ�ӦI�ġ�H��0������ͬ��ʱ����ڷ�Ӧ��230����Ӧ�ﵽƽ��״̬������ƽ�������ƶ���CO2ת��ת���ʽ��ͣ�CH3OH�����½���
�ʴ�Ϊ����ӦI�ġ�H��0�¶����ߣ�ʹCO2ת��ΪCH3OH��ƽ��ת�����½���
����ͼ���֪��230����CH3OH��ת������ߣ�����CZ(Zr��1)T��CH3OH��ѡ������ã���˺ϳɼ״��Ĺ�ҵ������230��������CZ(Zr��1)T��
�ʴ�Ϊ��BD��


 ��������ѧ����ϵ�д�
��������ѧ����ϵ�д� ��Ԫ������ĩ��ϵ�д�
��Ԫ������ĩ��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��±��Ԫ�ذ���F��Cl��Br��Ԫ�ء�
��1���������߱�ʾ±��Ԫ��ij��������˵�����ı仯���ƣ���ȷ����_______��
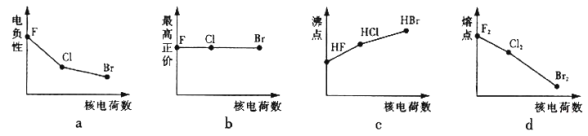
��2���ڲⶨHF����Է�������ʱ��ʵ��ⶨֵһ���������ֵ����Ҫԭ����______________��
��3��BCl3��NCl3����ԭ�ӵ��ӻ���ʽ�Ƿ���ͬ_____________���� �� �� ����һ�����ܽ���B��N֮��ĵڶ�����Ԫ����_______�֡�
��4���Rh���������ͬ����Ԫ�ء����ij�����Ļ�ѧʽΪCsRh(SO4)2��������������ˮ������ˮ��Һ�м���һ��Ũ�ȵ�BaCl2��Һ���������ɣ���������ˮ�ĵ��뷽��ʽΪ___________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NA��ʾ�����ӵ�����������������ȷ���ǣ� ��
A. ��״���£�22.4L H2O���еķ�����Ϊ1 NA
B. ���³�ѹ��,1.06g Na2CO3���е�Na+������Ϊ0.02 NA
C. ���³�ѹ�£�1 NA ��CO2����ռ�е����Ϊ22.4L
D. ���ʵ���Ũ��Ϊ0.5mol/L��MgCl2��Һ�У�����Cl- ����Ϊ1 NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ѧʵ������Ҫ1.500 mol��L��1������Һ450 mL��������Һ����������ش��������⣺
��1����ͼ��ʾ��������������Һ�϶�����Ҫ����______(�����)������������Һ�����õ��IJ���������________(����������)��
��2��������������Ϊ98%���ܶ�Ϊ1.84 g��cm��3��Ũ����������450 mL 1.50 mol��L��1��ϡ���ᡣ��������Ũ��������Ϊ________ mL (����1λС��)������ ��10 mL ��25 mL�� ��50 mL ��100 mL���ֹ�����Ͳ�����ѡ�õ���Ͳ��________(�����)��
��3������ʱ��һ��ɷ�Ϊ���¼������裺
����ȡ���ڼ��㡡��ϡ�͡���ҡ�ȡ���ת�ơ���ϴ�ӡ��߶��ݡ�����ȴ
����ȷ�IJ���˳��Ϊ��������������___��_____��_____��______����(�����)��
��4�������ƹ����У����в����лᵼ�������Ƶ���ҺŨ��ƫ�ߵ���________��
������Ͳ��ȡŨ����ʱ���ӿ̶���
��ϴ����ȡŨ��������Ͳ������ϴ��Һת�Ƶ�����ƿ��
��ת��ǰ������ƿ�к�����������ˮ
�ܶ���ʱ�����ӿ̶���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��Ʒ��Ҫ��KCl������MgCl2��CaCl2��MgSO4�ȣ���Ҫ�����ᴿ�õ�KCl��
��1��ʵ���Ҳ��ó������ⶨ��Ʒ��MgSO4�����������������������£�
��ȡ10g��Ʒ����ˮ�У�����������BaCl2��Һ����ֽ��跴Ӧ���ڽ����û������ˡ�ϴ�ӡ��۽�������ͬ��ֽȡ���������������������أ���ֽ��ȫת����CO2��ˮ���������ֽ⣩����ȴ��������ó�������Ϊ0.466g��
�жϳ����Ƿ�ϴ�Ӹɾ��ķ�����_______________����Ʒ��MgSO4����������Ϊ________��
��2�����м����Լ����������K2CO3����Na2CO3����NaOH����KOH����Ba(OH)2����BaCl2��Ϊ��Ч��ȥ��Ʒ�е����ʣ�������Լ���˳���������____________��
A���ߢۢ� B���ߢݢ� C���ڢ� D���ݢڢ�
���˳�ȥ��������Ҫ������Լ�Ϊ_________ (�����)��Ȼ����������ᾧ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ܡ��ѡ�ͭ��Ԫ�س������Ʊ�����ӵ�ص��������ϻ��Ч������NA��ʾ�����ӵ�����������д���пհס�
��1����̬Coԭ�ӵĵ����Ų�ʽΪ___��
��2������CO���ɵ������Ni(CO)4�У����ṩ�µ��ӶԵijɼ�ԭ����___����Ԫ�����ƣ���1 molNi(CO)4�к��е�������ĿΪ__��д����CO��Ϊ�ȵ������һ�������ӵĻ�ѧʽ_____��
��3��Ti(BH4)2��һ�ִ�����ϡ�BH4-�Ŀռ乹����____��Bԭ�ӵ��ӻ���ʽ__������ͬ���ڵĵڢ�B��͢�A������Ԫ���е�һ�����ܽϴ����___��дԪ�ط��ţ���ԭ����____��
��4��CuFeS2�ľ�����ͼ��ʾ�����������ֱ�Ϊanm��bnm��cnm��CuFeS2�ľ�����ÿ��Cuԭ����___��Sԭ�������������ܶ�����___g��cm3���г��������ʽ����

�Ծ�������Ϊ��λ���Ƚ���������ϵ���Ա�ʾ�����и�ԭ�ӵ�λ�ã�����ԭ�ӷ������꣬����ͼ��ԭ��2��3������ֱ�Ϊ��0��1��![]() ������
������![]() ��
��![]() ��0������ԭ��1������Ϊ___��
��0������ԭ��1������Ϊ___��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���װ�(CH3NH2)��һ��һԪ�������뷽��ʽΪ��CH3NH2 + H2O ![]() CH3NH3+ + OH���������£���20.0 mL 0.10 mol/L�ļװ���Һ�еμ�VmL0.10mol/L��ϡ���ᣬ�����Һ��pH�������Ũ�ȵĹ�ϵ��ͼ��ʾ������˵���д������
CH3NH3+ + OH���������£���20.0 mL 0.10 mol/L�ļװ���Һ�еμ�VmL0.10mol/L��ϡ���ᣬ�����Һ��pH�������Ũ�ȵĹ�ϵ��ͼ��ʾ������˵���д������
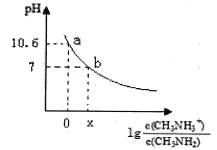
A. b���Ӧ������������V<20.00mL
B. �����£�����a���֪�װ��ĵ���ƽ�ⳣ��Kb=10 -3��4
C. b����ܴ��ڹ�ϵ��c(Cl��) > c(CH3NH3+) > c(H+) = c(OH��)
D. V=20.00mLʱ����Һ��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ں��¡��ݻ�Ϊ2L���ܱ�������ͨ��1 mol X��2 mol Y��������Ӧ��X(g)��2Y(g)![]() M(g)����H����a kJ/mol(a>0)��5 minĩ���M�����ʵ���Ϊ0��4 mol��������˵����ȷ����
M(g)����H����a kJ/mol(a>0)��5 minĩ���M�����ʵ���Ϊ0��4 mol��������˵����ȷ����
A. 0��5 min��Y��ƽ����Ӧ����Ϊ0��08 mol��L��1��min��1
B. �������л�������ܶȲ���ʱ�ﵽƽ��״̬
C. ƽ��������¶ȣ�X�ķ�Ӧ���ʽ���
D. ����ƽ��״̬ʱ����Ӧ�ų�������Ϊa kJ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ʵ�ת���ڸ�����������ʵ�ֵ���
A. Na![]() Na2O
Na2O![]() Na2CO3
Na2CO3
B. Al![]() Al2O3
Al2O3![]() Al(OH)3
Al(OH)3
C. Fe(OH)2![]() Fe(OH)3
Fe(OH)3![]() Fe2O3
Fe2O3
D. Na2CO3(aq)![]() NaHCO3
NaHCO3![]() CO2
CO2
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com