
【题目】下列说法中正确的是( )
A. 氨分子是三角锥形,而甲烷是正四面体形,是因为NH3分子中有一对未成键的孤电子对,它对成键电子的排斥作用较强
B. 杂化轨道全部参加形成化学键
C. PCl5分子中P原子和Cl原子最外层都满足8电子结构
D. 在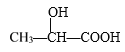 分子中含有2个手性C原子
分子中含有2个手性C原子
【答案】A
【解析】
A项、氨分子中氮原子的价层电子对数为4,孤对电子数为1,杂化轨道为sp3杂化,孤对电子对成键电子的排斥作用较强,N-H之间的键角小于109°28′,所以氨气分子空间构型是三角锥形;甲烷分子中碳原子的价层电子对数为4,孤对电子数为0,杂化轨道为sp3杂化,碳原子连接4个相同的原子,C-H之间的键角相等为109°28′,故CH4为正四面体构型,故A正确;
B项、杂化轨道可以部分参加形成化学键,例如氨分子中氮原子杂化轨道为sp3杂化,形成了4个sp3杂化轨道,但是只有3个参与形成化学键,故B错误;
C项、在化合物中,原子最外层电子数等于原子的价层电子数+|化合价|,PCl5中P原子的最外层电子为:5+5=10,Cl原子的最外层电子为:7+|-1|=8,不都满足8电子稳定结构,故C错误;
D项、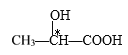 分子中,带*号碳原子所连的四个取代基分别是羟基、甲基、氢原子和羧基,该碳原子具有手性,分子中含有1个手性C原子,故D错误。
分子中,带*号碳原子所连的四个取代基分别是羟基、甲基、氢原子和羧基,该碳原子具有手性,分子中含有1个手性C原子,故D错误。
答案选A。


 名校通行证有效作业系列答案
名校通行证有效作业系列答案科目:高中化学 来源: 题型:
【题目】实验室需要0.1mol·L-1NaOH溶液450mL和0.5mol·L-1硫酸溶液500mL。根据这两种溶液的配制情况回答下列问题:
(1)如图所示的仪器中配制溶液肯定不需要的是__________(填序号),配制上述溶液还需用到的玻璃仪器是__________(填仪器名称)。
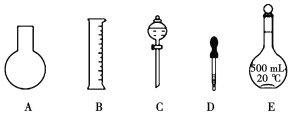
(2)配制0.1mol·L-1NaOH溶液操作步骤如下:
①把称量好的NaOH`固体放入小烧杯中,加适量蒸馏水溶解;
②把①所得溶液冷却至室温,再小心转入一定容积的容量瓶中;
③继续向容量瓶中加蒸馏水至液面距刻度线1~2cm处,改用胶头滴管小心滴加蒸馏水至溶液凹液面与刻度线相切;
④用少量蒸馏水洗涤烧杯和玻璃棒2~3次,每次洗涤的液体都小心转入容量瓶,并轻轻摇匀;
⑤将容量瓶瓶塞塞紧,充分摇匀。
操作步骤的正确顺序为__________(填序号)。
(3)根据计算用托盘天平称取NaOH的质量为__________g。在实验中其他操作均正确,若容量瓶用蒸馏水洗涤后未干燥,则所得溶液浓度______________0.10mol·L-1(填“大于”“等于”或“小于”,下同)。若还未等溶液冷却就定容了,则所得溶液浓度__________0.10mol·L-1。
(4)根据计算得知,所需质量分数为98%、密度为1.84g·cm-3的浓硫酸的体积为__________mL(计算结果保留一位小数)。如果实验室有10mL、15mL、20mL、50mL的量筒,应选用__________mL的量筒最好。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法错误的是( )
A. 因为二氧化硫具有漂白性,所以它能使品红溶液、溴水、高锰酸钾溶液褪色
B. 100mL0.5mol/LH2O2溶液与足量SO2完全反应,转移的电子数为0.1NA
C. 二氧化硫、Cl2以及活性炭都能使红墨水褪色,其原理不同
D. 等物质的量的二氧化硫和氯气相遇在溶液中具有更强的漂白能力
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生需要用烧碱固体配制0.5mol·L-1的NaOH溶液480mL。实验室提供以下仪器:
①100mL烧杯 ②100mL量筒 ③1000mL容量瓶 ④500mL容量瓶 ⑤玻璃棒 ⑥托盘天平(带砝码) ⑦药匙。请回答下列问题:
(1)计算需要称取NaOH固体_________g。
(2)配制时,必须使用的仪器有_______(填代号),还缺了仪器名称是_________。
(3)配制时,其正确的操作顺序是(字母表示,每个操作只用一次)________。
A.用少量水洗涤烧杯2~3次,洗涤液均注入容量瓶,振荡
B.在盛有NaOH固体的烧杯中加入适量水溶解
C.将烧杯中已冷却的溶液沿玻璃棒注入容量瓶中
D.将容量瓶盖紧,反复上下颠倒,摇匀
E.改用胶头滴管加水,使溶液凹面恰好与刻度相切
F.继续往容量瓶内小心加水,直到液面接近刻度1~2cm处
(4)若出现如下情况,其中将引起所配溶液浓度偏高的是___。(填下列编号)
①容量瓶实验前用蒸馏水洗干净,但未烘干 ②定容观察液面时俯视
③配制过程中遗漏了(3)中步骤A ④加蒸馏水时不慎超过了刻度
⑤未等NaOH溶液冷却至室温就转移到容量瓶中
(5)用配制好的溶液,再来配制50ml0.2mol·Lˉ1的NaOH溶液,需要取原配好的溶液_____ml。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】课外小组用如图所示装置制取溴苯。先向分液漏斗中加入苯和液溴,再将混合液慢慢滴入反应器A(A下端活塞关闭)中。
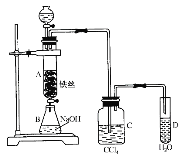
(1)写出A中反应的化学方程式:________________________,反应类型为____________。
(2)观察A中的现象是:___________________________________________________。
(3)实验结束时,打开A下端的活塞,让反应液流入B中,充分振荡,目的是_______,写出有关化学方程式___________。
(4)C中盛放CCl4的作用是______________________________________。
(5)能证明苯和液溴发生的是取代反应,而不是加成反应,可向试管D中加入AgNO3溶液,若产生淡黄色沉淀,则能证明。另一种验证方法是向试管D中加入________,现象是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】废旧电池的回收处理,既能减少对环境的污染,又能实现资源的再生利用。将废旧锌锰电池初步处理后,所得废料含MnO2、MnOOH、Zn(OH)2及少量Fe等,用该废料制备Zn和MnO2的一种工艺流程如下:
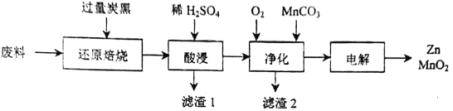
已知:
①Mn2+在酸性条件下比较稳定,pH高于5.5时易被O2氧化
②有关Ksp数据如下表所示
化合物 | Mn(OH)2 | Zn(OH)2 | Fe(OH)3 |
Ksp近似值 | 10-13 | 10-17 | 10-38 |
回答下列问题:
(1)还原焙烧过程中, MnOOH与炭黑反应,锰元素被还原为MnO,该反应的化学方程式为___________。传统的工艺是使用浓盐酸在加热条件下直接处理废料,缺点是___________。
(2)酸漫时一般会适当加热并不断搅拌,其作用是___________,滤渣1和滤渣2主要成分的化学式依次是___________。
(3)净化时,先通入O2再加入MnCO3,其目的是___________;已知净化时溶液中Mn2+、Zn2+的浓度约为0.1mol·L-1,调节pH的合理范围是___________。
(4)电解制取MnO2时,MnO2在___________极产生。
(5)中科院研究人员将MnO2和生物质置于一个由滤纸制成的折纸通道内形成电池,该电池可将软饮料中的葡萄糖作为燃料获得能量,装置如图所示。此装置中b极的电极反应式为______________________。
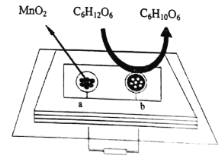
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】卤族元素包括F、Cl、Br等元素。
(1)下列曲线表示卤族元素某种性质随核电荷数的变化趋势,正确的是_______。
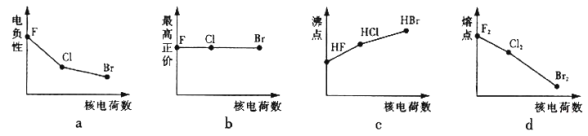
(2)在测定HF的相对分子质量时,实验测定值一般高于理论值的主要原因是______________。
(3)BCl3和NCl3中心原子的杂化方式是否相同_____________(填 是 或 否)。第一电离能介于B、N之间的第二周期元素有_______种。
(4)铑(Rh)与碘属于同周期元素。铑的某配合物的化学式为CsRh(SO4)2,该物质易溶于水,向其水溶液中加入一定浓度的BaCl2溶液,无沉淀生成,该盐溶于水的电离方程式为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有X、Y、Z三种元素,已知:①X、Y、Z的单质在常温下均为气体;②X单质可在Z单质中燃烧,生成XZ,火焰为苍白色;③XZ极易溶于水,其水溶液可使蓝色石蕊试纸变红;④每2个X2分子可与1个Y2分子化合生成2个X2Y分子,X2Y在常温下为液体;⑤Z单质溶于X2Y中,所得溶液具有漂白作用;⑥细铁丝能在Z2(g)中剧烈燃烧,且产生红棕色烟。推断:
(1)X、Y两种元素的名称X___,Y___。
(2)化合物的化学式:XZ___,X2Y___。
(3)过程⑥中涉及的化学反应方程式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学实验室需要1.500 mol·L-1硫酸溶液450 mL。根据溶液的配制情况回答下列问题:
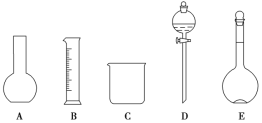
(1)如图所示的仪器中配制溶液肯定不需要的是______(填序号),配制上述溶液还需用到的玻璃仪器是________(填仪器名称)。
(2)现用质量分数为98%、密度为1.84 g·cm-3的浓硫酸来配制450 mL 1.50 mol·L-1的稀硫酸。计算所需浓硫酸的体积为________ mL (保留1位小数),现有 ①10 mL ②25 mL ③50 mL ④100 mL四种规格的量筒,最好选用的量筒是________(填代号)。
(3)配制时,一般可分为以下几个步骤:
①量取 ②计算 ③稀释 ④摇匀 ⑤转移 ⑥洗涤 ⑦定容 ⑧冷却
其正确的操作顺序为:②→①→③→___→_____→_____→______→④(填序号)。
(4)在配制过程中,下列操作中会导致所配制的溶液浓度偏高的有________。
①用量筒量取浓硫酸时候,俯视刻度线
②洗涤量取浓硫酸后的量筒,并将洗涤液转移到容量瓶中
③转移前,容量瓶中含有少量蒸馏水
④定容时,俯视刻度线
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com