
| A、加入稀盐酸产生无色无味气体,将气体通入澄清石灰水中,溶液变浑浊,则一定有CO32- |
| B、加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,则一定有SO42- |
| C、分别含有Mg2+、Cu2+和Na+的三种盐酸盐溶液,用NaOH溶液就能一次鉴别开 |
| D、加入碳酸钠溶液产生白色沉淀,再加盐酸,白色沉淀消失,一定有Ba2+ |


科目:高中化学 来源: 题型:
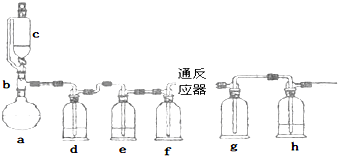
| 观察到的部分现象 | |
| 第一次实验 | 反应器中有白雾、红色固体、g瓶有白雾和黄绿色气体 |
| 第二次实验 | 反应器中有绿色晶体,g瓶有红棕色的烟和黄绿色气体 |
| 第三次实验 | 反应器中有绿色晶体,g瓶有黄绿色气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、H2O(g)═H2(g)+1
| ||
B、H2O(g)═H2(g)+
| ||
| C、2 H2(g)+O2(g)═2 H2O(g)△H=+485 KJ.mol-1 | ||
| D、2 H2(g)+O2(g)═2 H2O(g)△H=-485 KJ.mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、K+一定存在 |
| B、100mL溶液中含0.01mol CO32- |
| C、Cl-一定存在 |
| D、Fe3+一定不存在,Mg2+可能存在 |
查看答案和解析>>
科目:高中化学 来源: 题型:
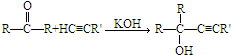 已知:
已知:
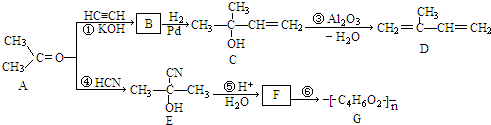
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 操作及现象 | 溶液 |
| A | 通入CO2,溶液变浑浊.继续通CO2至过量,浑浊不消失. | NaAlO2溶液 |
| B | 通入CO2,溶液变浑浊.继续通CO2至过量,浑浊消失. | Na2SiO3溶液 |
| C | 通入CO2,溶液变浑浊.再加入品红溶液,红色褪去. | Ca(ClO)2溶液 |
| D | 通入CO2,溶液变浑浊.继续通CO2至过量,浑浊消失.再加入足量NaOH溶液,又变浑浊. | Ca(OH)2溶液 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、已知PM2.5是指大气中直径≤2.5×10-6 m的颗粒物则PM为2.5的大气一定能产生丁达尔效应 | ||||
| B、根据电解质在水溶液中电离的程度,将电解质分为强电解质和弱电解质 | ||||
| C、根据是否具有丁达尔效应,将分散系分为溶液、浊液和胶体 | ||||
D、
|
查看答案和解析>>
科目:高中化学 来源: 题型:
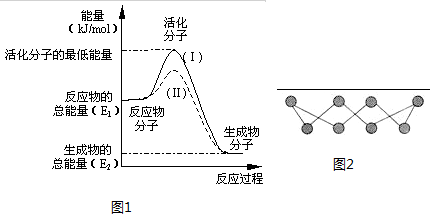 在化学反应中,只有能量比平均能量高得多的反应物分子发生碰撞时才可能发生化学反应,这些分子称为活化分子.使普通分子变成活化分子所需提供的最低限度的能量叫活化能,其单位通常用kJ?mol-1表示.请认真观察图1然后回答问题.
在化学反应中,只有能量比平均能量高得多的反应物分子发生碰撞时才可能发生化学反应,这些分子称为活化分子.使普通分子变成活化分子所需提供的最低限度的能量叫活化能,其单位通常用kJ?mol-1表示.请认真观察图1然后回答问题.| 化学键 | H-S | S-S | S=O | H-O |
| 键能/KJ?mol-1 | 364 | 266 | 522 | 464 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com