
分析 (1)据已知热化学方程式,利用盖斯定律解答;
(2)0~5小时时CO的浓度从0变化到0.60mol/L,据化学方程式求算氢气的反应速率;化学平衡常数K=$\frac{[CO]^{2}•[{H}_{2}]^{2}}{[C{H}_{4}]•[C{O}_{2}]}$;再往容器中充0.4molCH4和0.2molCO,据Qc和K的大小比较判断平衡移动方向;
(3)从反应放热和吸热角度分析;
(4)pH=12,c(OH-)=0.01mol/L,据Ksp[Ni(OH)2]=5×10-16计算c(Ni2+).
解答 解:(1)已知①CH4(g)+$\frac{1}{2}$O2(g)?CO(g)+2H2(g)△H=-36kJ/mol
②CH4(g)+H2O(g)?CO(g)+3H2(g)△H=+206kJ/mol
③CH4(g)+CO2(g)?2CO(g)+2H2(g)△H=+247kJ/mol副反应
④CH4(g)+2O2(g)?CO2(g)+2H2O (g)△H=-889.6kJ/mol
根据盖斯定律,③-②得:CO2 (g)+H2(g)?CO (g)+H2O(g)△H=247kJ/mol-206kJ/mol=41kJ/mol,故答案为:41kJ/mol;
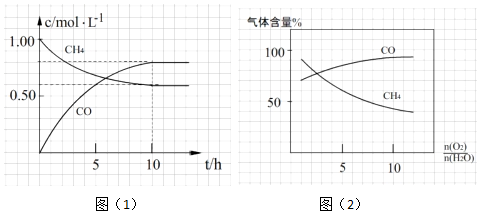
(2)0~5小时时CO的浓度从0变化到0.60mol/L,据化学方程式可知,氢气的反应速率v(H2)=$\frac{0.60mol/L}{5h}$=0.12mol/(L•h);
平衡时浓度[CO]=[H2]=0.8mol/L,[CO2]=[CH4]=0.60mol/L,化学平衡常数K=$\frac{[CO]^{2}•[{H}_{2}]^{2}}{[C{H}_{4}]•[C{O}_{2}]}$=$\frac{0.{8}^{2}×0.{8}^{2}}{0.6×0.6}$=1.1;再往容器中充0.4molCH4和0.2molCO,容器体积为1L,Qc=$\frac{1.{0}^{2}×0.{8}^{2}}{1.0×0.6}$=1.07<1.1,平衡正向移动,故答案为:0.12mol/(L•h);1.1(mol/L)2;正;
(3)反应①CH4(g)+$\frac{1}{2}$O2(g)?CO(g)+2H2(g)△H=-36kJ/mol
②CH4(g)+H2O(g)?CO(g)+3H2(g)△H=+206kJ/mol
③CH4(g)+CO2(g)?2CO(g)+2H2(g)△H=+247kJ/mol副反应
④CH4(g)+2O2(g)?CO2(g)+2H2O (g)△H=-889.6kJ/mol
中,反应②③是吸热反应,反应①④是放热反应,增加n(O2)/n(H2O),①④将向正方向移动,反应产生的热量促使反应②③向正方向移动,
故答案为:反应②③是吸热反应,反应①④是放热反应,增加n(O2)/n(H2O),①④将向正方向移动,反应产生的热量促使反应②③向正方向移动;
(4)pH=12,c(OH-)=0.01mol/L,Ksp[Ni(OH)2]=5×10-16,c(Ni2+)=$\frac{5×1{0}^{-16}}{(1{0}^{-2})^{2}}$=5×10-12mol/L,故答案为:5×10-12mol/L.
点评 本题考查了盖斯定律的应用、影响化学平衡移动的因素、沉淀的溶度积计算,题目难度中等,注意根据反应热判断反应方向的相互影响.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:多选题
| A. | 质子数为8、中子数为10的氧原子:${\;}_{8}^{18}$O | |
| B. | 氧离子(O2-)的结构示意图: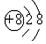 | |
| C. | 氧原子最外层p亚层电子排布式:2s22p4 | |
| D. | 某碳氧化合物电子式: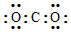 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用苯萃取溴水中的溴时,将溴的苯溶液从分液漏斗下口放出 | |
| B. | 中和滴定实验中,锥形瓶用蒸馏水洗净须经烤箱烘干后才可使用 | |
| C. | 配制0.5mol•L-1、480mL的NaOH溶液需称量9.6g的NaOH固体作溶质 | |
| D. | 某溶液中滴入2滴K3[Fe(CN)6]溶液生成具有特征蓝色的沉淀,说明原溶液中含有Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.01mol/L 标准盐酸溶液滴定未知浓度氨水,可以使用甲基橙作指示剂 | |
| B. | 向0.01mol/L酸性高锰酸钾溶液中滴加适量0.1mol/L草酸溶液,振荡,一段时间后溶液突然变为无色 | |
| C. | 向1mol/L KI溶液中逐滴滴加适量0.1mol/L稀硫酸和淀粉溶液,振荡,一段时间后无明显现象 | |
| D. | 向1mL 0.1mol/L MgCl2溶液的试管中滴加1~2滴2mol/L NaOH溶液,振荡后出现白色沉淀,再滴加2滴0.1mol/L FeCl3溶液,沉淀变为红褐色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 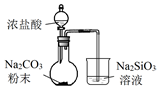 验证H2CO3酸性强于H2SiO3 | B. | 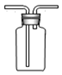 收集CO2或NH3 | ||
| C. | 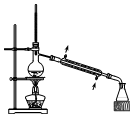 分离Na2CO3溶液与CH3COOC2H5 | D. | 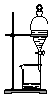 分离CH3CH2OH与CH3COOC2H5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ne和Na+的结构示意图均为  | B. | 聚氯乙烯的结构简式为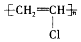 | ||
| C. | 二氧化碳分子的比例模型: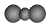 | D. | NH4Br的电子式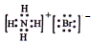 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
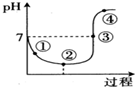
| A. | 点①所示溶液中:c(H+)=c(Cl-)+c(HClO)+c(OH-) | |
| B. | 点②所示溶液中:c(H+)>c(Cl-)>c(ClO-)>c(HClO) | |
| C. | 点③所示溶液中:c(Na+)=2c(ClO-)+c(HClO) | |
| D. | 点④所示溶液中:c(Na+)>c(ClO-)>c(Cl-)>c(HClO) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 纯铁比生铁更耐腐蚀 | |
| B. | 明矾水解形成胶体能吸附悬浮物,可用于净水 | |
| C. | 碳酸钠溶液呈碱性是因为其在水中电离出OH- | |
| D. | 工业废水中的Cu2+和Hg2+可用Na2S或H2S除去 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com