
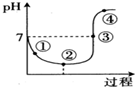
| A. | 点①所示溶液中:c(H+)=c(Cl-)+c(HClO)+c(OH-) | |
| B. | 点②所示溶液中:c(H+)>c(Cl-)>c(ClO-)>c(HClO) | |
| C. | 点③所示溶液中:c(Na+)=2c(ClO-)+c(HClO) | |
| D. | 点④所示溶液中:c(Na+)>c(ClO-)>c(Cl-)>c(HClO) |
分析 氯气溶于水发生反应Cl2(aq)+H2O?HClO+H++Cl- 导致溶液呈酸性,加入NaOH溶液后促进氯气溶解导致溶液酸性增强,当NaOH和HCl完全反应时溶液酸性最强,继续加入NaOH溶液,NaOH和HClO反应生成次氯酸钠导致溶液酸性减弱、碱性增强,
①中溶质为NaCl、HClO,②中溶质为NaCl、HClO,③中溶质为NaCl、HClO、NaClO,④中溶质为
NaCl、NaClO,溶液中存在电荷守恒和物料守恒,据此分析解答.
解答 解:氯气溶于水发生反应Cl2(aq)+H2O?HClO+H++Cl- 导致溶液呈酸性,加入NaOH溶液后促进氯气溶解导致溶液酸性增强,当NaOH和HCl完全反应时溶液酸性最强,继续加入NaOH溶液,NaOH和HClO反应生成次氯酸钠导致溶液酸性减弱、碱性增强,
①中溶质为NaCl、HClO,②中溶质为NaCl、HClO,③中溶质为NaCl、HClO、NaClO,④中溶质为
NaCl、NaClO,
A.点①所示溶液中存在电荷守恒:c(H+)=c(Cl-)+c(ClO-)+c(OH-),HClO电离程度较小,则溶液中c(HClO)>c(ClO-),所以c(H+)<c(Cl-)+c(HClO)+c(OH-),故A错误;
B.点②所示溶液酸性最强,溶液中HClO浓度最大,HClO是弱电解质,电离程度较小,则溶液中存在:
c(H+)>c(Cl-)>c(HClO)>c(ClO-),故B错误;
C.点③所示溶液呈中性,则c(H+)=c(OH-),则溶液中存在电荷守恒:
c(Na+)=c(ClO-)+c(Cl-),存在物料守恒c(Cl-)=c(ClO-)+c(HClO),所以得c(Na+)=2c(ClO-)+c(HClO),故C正确;
D.点④所示溶液中溶质为NaCl、NaClO,且次氯酸根离子水解,所以溶液中存在:c(Na+)>c(Cl-)>c(ClO-)>c(HClO),故D错误;
故选C.
点评 本题以酸碱混合溶液定性判断为载体考查离子浓度大小比较,为高频考点,侧重考查学生图象分析、判断能力,明确各点溶液中溶质成分及其性质是解本题关键,注意电荷守恒和物料守恒的灵活运用,题目难度中等.


 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案科目:高中化学 来源: 题型:选择题
| A. | ClO-、K+、Cl- | B. | Ba2+、Na+、Br- | C. | Na+、Fe3+、SO42- | D. | K+、NO3-、NH4+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
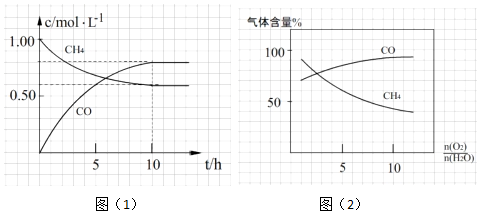
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 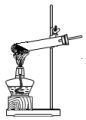 制备NH3 | B. | 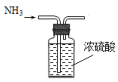 干燥NH3 | C. | 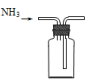 收集NH3 | D. | 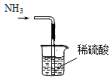 吸收多余NH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
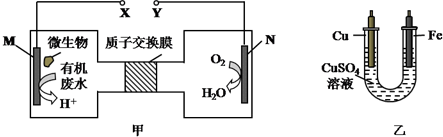
| A. | 乙装置中溶液颜色会变浅 | |
| B. | 铁电极应与Y相连接 | |
| C. | M电极反应式:H2NCONH2+H2O-6e-═CO2↑+N2↑+6H+ | |
| D. | 当N电极消耗0.25mol气体时,则铜电极质量减少16g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:2 | B. | 3:2 | C. | 2:3 | D. | 2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaAlO2溶液 | B. | Na2SiO3溶液 | C. | BaCl2溶液 | D. | Ca(ClO)2溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:W>Y>Z>X | |
| B. | 气态氢化物的稳定性:X<Z | |
| C. | 最高价氧化物对应水化物的碱性:Y>W | |
| D. | Y的氧化物是酸性氧化物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com