
| A. | 1:2 | B. | 3:2 | C. | 2:3 | D. | 2:1 |
分析 (NH4)2SO4和NH4HSO4混合物样品中加入NaOH溶液,NH4HSO4电离出的氢离子优先反应,剩余的NaOH与铵根离子反应生成氨气,根据n=$\frac{V}{{V}_{m}}$计算出氨气的物质的量,然后根据关系式NH4+~OH-计算出生成该氨气消耗氢氧根离子的物质的量,再结合NaOH的物质的量可计算出混合物中NH4HSO4的物质的量;根据m=nM计算出硫酸铵的质量,再根据n=$\frac{m}{M}$计算出硫酸铵的物质的量,最后可计算出(NH4)2SO4和NH4HSO4的物质的量比.
解答 解:(NH4)2SO4和NH4HSO4混合物样品中加入NaOH溶液,NH4HSO4电离出的氢离子优先反应,
标准状况下1792mL 氨气的物质的量为:$\frac{1.792L}{22.4L/mol}$=0.08mol,
根据NH4+~OH-可知与氢离子反应消耗NaOH的物质的量为:0.1mol-0.08mol=0.02mol,则NH4HSO4的物质的量为0.02mol,
所以(NH4)2SO4的质量为:7.58g-115g/mol×0.02mol=5.28g,其物质的量为:$\frac{5.28g}{132g/mol}$=0.04mol,
则(NH4)2SO4和NH4HSO4的物质的量比=0.04mol:0.02mol=2:1,
故选D.
点评 本题考查了混合物反应的计算,题目难度中等,明确发生反应的先后顺序为解答关键,注意掌握物质的量与摩尔质量、气体摩尔体积之间的关系,试题培养了学生的分析能力及化学计算能力.


 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案科目:高中化学 来源: 题型:多选题
| A. | 质子数为8、中子数为10的氧原子:${\;}_{8}^{18}$O | |
| B. | 氧离子(O2-)的结构示意图: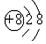 | |
| C. | 氧原子最外层p亚层电子排布式:2s22p4 | |
| D. | 某碳氧化合物电子式: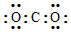 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ne和Na+的结构示意图均为 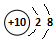 | B. | 聚氯乙烯的结构简式为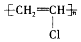 | ||
| C. | 二氧化碳分子的比例模型: | D. | NH4Br的电子式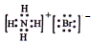 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
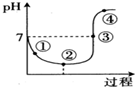
| A. | 点①所示溶液中:c(H+)=c(Cl-)+c(HClO)+c(OH-) | |
| B. | 点②所示溶液中:c(H+)>c(Cl-)>c(ClO-)>c(HClO) | |
| C. | 点③所示溶液中:c(Na+)=2c(ClO-)+c(HClO) | |
| D. | 点④所示溶液中:c(Na+)>c(ClO-)>c(Cl-)>c(HClO) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氮氧化合物、PM 2.5颗粒、CO2都会导致酸雨 | |
| B. | 氯水和二氧化硫混合使用能增强漂白效果 | |
| C. | 硫酸铜溶液可用于泳池消毒是利用了Cu2+能使蛋白质盐析 | |
| D. | 轮船上挂锌锭防止铁腐蚀属于牺牲阳极的阴极保护法 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 NH4Al(SO4)2、NH4HSO4在分析试剂、医药、电子工业中用途广泛.请回答下
NH4Al(SO4)2、NH4HSO4在分析试剂、医药、电子工业中用途广泛.请回答下查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 纯铁比生铁更耐腐蚀 | |
| B. | 明矾水解形成胶体能吸附悬浮物,可用于净水 | |
| C. | 碳酸钠溶液呈碱性是因为其在水中电离出OH- | |
| D. | 工业废水中的Cu2+和Hg2+可用Na2S或H2S除去 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 在一定条件下用普通铁粉和水蒸气反应,可以得到铁的氧化物.实验中其他试剂自选(装置中必要的铁架台、铁夹、铁圈、石棉网、加热设备等在图中均已略去).根据图示判断下列说法不正确的是( )
在一定条件下用普通铁粉和水蒸气反应,可以得到铁的氧化物.实验中其他试剂自选(装置中必要的铁架台、铁夹、铁圈、石棉网、加热设备等在图中均已略去).根据图示判断下列说法不正确的是( )| A. | 实验进行时试管 A 中应加入的试剂是普通铁粉 | |
| B. | 烧瓶 B 的作用是防止倒吸,烧瓶 C 的作用是产生水蒸气 | |
| C. | 试管 D 中收集得到的是 H2 | |
| D. | 3 mol 单质 Fe 全部转变为 Fe3O4,失去 8 mol 电子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com