
����Ŀ������ѧ������ѧ�뼼�����������ƿ������ڸ��Ƶر�ˮ�ʡ��������ؽ������ӷ�ˮ�������ೱ��Ҳ������Ӧ�������ȡ�ʵ���ҿ��ù�ҵ̼���(��MgCO3��FeCO3������)��ȡ������̼��ƣ�Ȼ�����ô���̼�����ȡ�������ƣ�����Ҫ�������£�
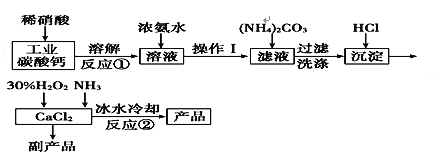
��֪��CaO2��8H2O�ʰ�ɫ����ˮ��������350�����ҿ�ʼ�ֽ�ų�������425���ֽ���ȫ��
��1��д����Ӧ����������ԭ��Ӧ�����ӷ���ʽ��___________________________��
��2����Ӧ�������Һ�м�Ũ��ˮ��Ŀ���ǣ�___________��________(�÷���ʽ��ʾ)
��3����Ӧ�����ñ�ˮ�����¶���0�����ң������ԭ����(д������)��
��__________________________����__________________________��
��4���ⶨ��Ʒ��CaO2�ĺ�����ʵ�鲽����
��һ����ȷ��ȡa g��Ʒ��������ƿ�У�������������ˮ������b g KI���壬�ٵ�������2 mol/L��H2SO4��Һ����ַ�Ӧ��
�ڶ�������������ƿ�м��뼸�ε�����Һ��
����������μ���Ũ��Ϊc mol��L��1��Na2S2O3��Һ����Ӧ��ȫ������Na2S2O3��ҺV mL����֪��I2��2S2O===2I����S4O��
ijͬѧ��һ���͵ڶ����IJ������ܹ淶������������̫����������õ�CaO2��������������________(�����Ӱ�족��ƫ�͡���ƫ�ߡ�)��ԭ����____________________.
���𰸡�(����ע3�����������2��) ��1��3FeCO3��10H����NO===3Fe3����NO����3CO2����5H2O(3��)
��2��Mg2��+��Fe3��������ȫ(����ʽ��) ��3������ֹH2O2�ֽ⣬�����������
������CaO2��8H2O�ܽ�ȣ���߲��� ��4��ƫ�� �����������¿����е�O2Ҳ����KI����ΪI2��ʹ���ĵ�Na2S2O3���࣬�Ӷ�ʹ��õ�CaO2����������ƫ��
��������
�����������1����Ӧ����ֻ��FeCO3�����ᷴӦ��������ԭ��Ӧ������������һ��������������̼��ˮ����Ӧ����ʽΪ��3FeCO3+10H++NO3-=3Fe3++NO��+3CO2��+5H2O��
��2�����백ˮʹMg2+��Fe3+������ȫ����Ӧ�����ӷ���ʽΪ��Mg2++2NH3H2O=Mg(OH)2��+2NH4+�� Fe3++3NH3H2O=Fe(OH)3��+3NH4+��
��3��H2O2�����ֽ⣬���ñ�ˮ�����¶���0�����ң���ֹ��ֽ⣬��������ʣ�ͬʱ�¶ȵ��ܽ���CaO28H2O�ܽ�ȣ���߲�����
��4��ijͬѧ��һ���͵ڶ����IJ������ܹ淶������������̫����������õ�CaO2��������������ƫ�ߣ���Ϊ�����������¿����е�O2Ҳ����KI����ΪI2��ʹ���ĵ�Na2S2O3���࣬�Ӷ�ʹ��õ�CaO2����������ƫ����


 �żӾ���ϵ�д�
�żӾ���ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��CH4��NH3��H2O��HF��Ϊ��10e���ķ��ӡ�
��1��N��O��F����Ԫ���У����̬Cԭ�ӵĺ���δ�ɶԵ�������ȵ�Ԫ���� ��дԪ�����ƣ������̬ԭ�ӵļ۲�����Ų�ͼΪ ��
��2��C��N��O��F����Ԫ�ص�һ�������ɴ�С��˳���� ����Ԫ�ط��ű�ʾ����
��3��CH4��NH3��H2O�����У���ԭ�ӹ�����ص�������˵�����ַ��Ӿ������ۼ�����Ϊ �����ַ��ӵ�����ԭ�ӵ��ӻ�������;�Ϊ ��
��4��CH4ȼ������CO��CO2��H2O��
����CO�����������Ƚ�������Ni����������ɫ�ӷ���Һ̬Ni(CO)4�����Ʋ����ʻ����ľ�������Ϊ ��
��OCN����CO2��Ϊ�ȵ����壬��OCN���ṹʽΪ ��
��5����̼ͬ��Ĺ��γɵĹ����νṹ�еĻ����ṹ��ԪΪ[SiO4]�����壬�������ṹ��Ԫͨ������һ��ԭ���γɵĹ����������ӵĻ�ѧʽΪ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��A��B��C����ǿ����ʣ�������ˮ�е�������������±���ʾ��
������ | Na����K����Cu2�� |
������ | SO��OH�� |
����ͼ��ʾװ���У��ס��ҡ��������ձ����ηֱ�ʢ��������A��Һ��������B��Һ��������C��Һ���缫��Ϊʯī�缫��

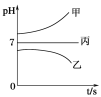
��ͨ��Դ������һ��ʱ�������ձ���c�缫����������16 g�������¸��ձ�����Һ��pH����ʱ��t�Ĺ�ϵ����ͼ���ݴ˻ش��������⣺
��1��MΪ��Դ��_____��(���������)���缫b�Ϸ����ĵ缫��ӦΪ__________________��
��2���缫e�����ɵ������ڱ�״̬�µ����Ϊ________��
��3��д�����ձ��еĵ��ط�Ӧ_______________________��
��4��Ҫʹ���ձ��е�C��Һ�ָ���ԭ����״̬����ȷ�IJ���__________�������������ݣ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��K2Cr2O7��Һ�д���ƽ�⣺Cr2O72-����ɫ��+H2O![]() 2CrO42-����ɫ��+2H+����K2Cr2O7��Һ��������ʵ�飺
2CrO42-����ɫ��+2H+����K2Cr2O7��Һ��������ʵ�飺
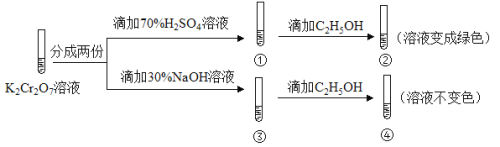
���ʵ�飬����˵������ȷ����
A��������Һ��ɫ���������Һ���
B������Cr2O72-��C2H5OH��ԭ
C���Ա���������֪K2Cr2O7������Һ������ǿ
D���������м���70%H2SO4��Һ����������Һ��Ϊ��ɫ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ϳɰ���ҵΪ��������ʳ���������˾��ס�һ�������£����ܱ������н��кϳɰ���Ӧ��N2��g�� + 3H2��g��![]() 2NH3��g�����������淴Ӧ��������Ҳ�������ʱ������˵������ȷ����
2NH3��g�����������淴Ӧ��������Ҳ�������ʱ������˵������ȷ����
A��N2��H2��ȫת��ΪNH3
B��N2��H2��NH3���������
C����Ӧ�Ѵﵽ��ѧƽ��״̬
D��N2��H2��NH3��Ũ�Ȳ��ٸı�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ݻ�Ϊ2 L���ܱ������н������·�Ӧ:A(g)+2B(g) ![]() 3C(g)+nD(g)����ʼʱAΪ4 mol��BΪ6 mol��5 minĩʱ���C�����ʵ���Ϊ3 mol����D��ʾ�Ļ�ѧ��Ӧ����v(D)Ϊ0.2 mol/(L��min)������:
3C(g)+nD(g)����ʼʱAΪ4 mol��BΪ6 mol��5 minĩʱ���C�����ʵ���Ϊ3 mol����D��ʾ�Ļ�ѧ��Ӧ����v(D)Ϊ0.2 mol/(L��min)������:
��1��5 minĩA�����ʵ���Ũ��Ϊ ��
��2��ǰ5 min����B��ʾ�Ļ�ѧ��Ӧ����v(B)Ϊ ��
��3����ѧ����ʽ��nֵΪ ��
��4�� 5min��A��ת����Ϊ ��
��5���˷�Ӧ�����ֲ�ͬ����µķ�Ӧ���ʷֱ�Ϊ:
��v(A)=5 mol/(L��min) ��v(B)= 6 mol/(L��min)
��v(C)=4.5 mol/(L��min) ��v(D)=8 mol/(L��min)
���з�Ӧ���������� (����)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ѧ����ѡ��5:�л���ѧ�������й���ѧ���������������ص��о��ٻ���2015��ŵ������ѧ�����������Ǽ��Ұ���ड���ୡ����֮������Ч�Ŀ�ű��Чҩ��������Ч�͵Ͷ����ص㣬��������������֯�����ǡ�������Ψһ��Ч��ű������ҩ����������غϳ�ϵ��������(���ǵ����ƺʹ�����ͼ��ʾ)��·����ͼ��
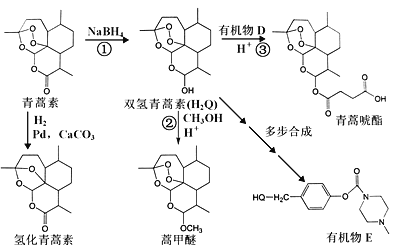
��֪��
![]()
�ش��������⣺
��1�������صķ���ʽΪ_____________________��
��2����Ӧ���У��л���Ӧ����Ϊ___________��NaBH4��������________��(A�������� B����ԭ�� C������ D���ܼ�)
��3���л���D�Ƿ���ʽΪC4H4O3����Ԫ��״�������д��D�Ľṹ��ʽ ��
��4�����ﻣ���ܹ������ķ�Ӧ������ ��
A��������Ӧ B��ˮ�ⷴӦ C����ԭ��Ӧ D���Ӿ۷�Ӧ
��5����H2Q��ʾ˫�������أ�д����Ӧ��(˫�������غͼ״���Ӧ)�Ļ�ѧ����ʽ_________��
��6����˫��������(H2Q)��������ͨ���ಽ��Ӧ�ϳɳ��л���E���ϳɹ����У��л�ԭ�ϳ�H2Q��![]() �⣬���躬�����Ķ��ǻ�������F��д���л���F��NaOH��Һ��Ӧ�����ӷ�Ӧ����ʽ___________________________���л���G��F��ͬ���칹�壬�л���G��FeCl3��Һ����ɫ������4�ֲ�ͬ���͵��⣬�������Ϊ3:2:2:1��������������л���G��ͬ���칹����_____�֡�д������һ�ֵĽṹ��ʽ ��
�⣬���躬�����Ķ��ǻ�������F��д���л���F��NaOH��Һ��Ӧ�����ӷ�Ӧ����ʽ___________________________���л���G��F��ͬ���칹�壬�л���G��FeCl3��Һ����ɫ������4�ֲ�ͬ���͵��⣬�������Ϊ3:2:2:1��������������л���G��ͬ���칹����_____�֡�д������һ�ֵĽṹ��ʽ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ��Ӧԭ���ڿ��к��������й㷺Ӧ�ã�
��Ԫ���ں����е�ѭ����������������̬ϵͳ�Ļ����ؼ���������������ѭ�����̿�����ͼ��ʾ��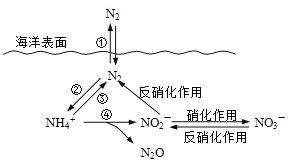
��1�������еĵ�ѭ����ʼ�ڵ��Ĺ̶����������ڹ̵����õ�һ���� ����ͼ�������������
��2������ʱ��������ϸ�������£�NH4+��ʵ�ֹ��̢ܵ�ת���������̢ܵ����ӷ���ʽ����������________NH4+ + 5O2 == 2NO2- + ________H+ +__________+__________��
��ҵ�ϳɰ�ԭ���ǣ�N2��g��+3H2��g��![]() 2NH3��g�� ��H <0������Ӧ���а�n��N2����n��H2��=1��3Ͷ�ϣ��ֱ���200����400����600���´ﵽƽ��ʱ���������NH3�����ʵ���������ѹǿ�ı仯������ͼ��
2NH3��g�� ��H <0������Ӧ���а�n��N2����n��H2��=1��3Ͷ�ϣ��ֱ���200����400����600���´ﵽƽ��ʱ���������NH3�����ʵ���������ѹǿ�ı仯������ͼ��
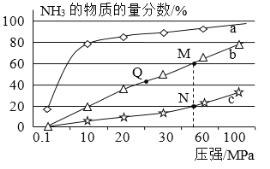
��3������a��Ӧ���¶��� ��
��4�����ڹ�ҵ�ϳɰ��ķ�Ӧ������������ȷ���� ��
A����ʱ�����NH3�������H2��ƽ��ת����
B����ͼ��M��N��Q��ƽ�ⳣ��K�Ĵ�С��ϵ
��K��M��=K��Q����K��N��
C��M���N��ķ�Ӧ���ʿ�
D��������a��֪����ѹǿ���ӵ�100 MPa���ϣ�NH3�����ʵ��������ɴﵽ100%
��5�����N��ʱc��NH3����0.2mol��L��1��N��Ļ�ѧƽ�ⳣ��K�� L2/mol2 ����ȷ��С�������λ����
����������һ�ַdz���Ҫ�ĸ�Ч���ʣ���ҵ����NH3��CO2Ϊԭ���������أ��÷�Ӧʵ��Ϊ������Ӧ��
��һ����2NH3��g����CO2��g��![]() H2NCOONH4��s�� ��H=��272kJ��mol��1
H2NCOONH4��s�� ��H=��272kJ��mol��1
�ڶ�����H2NCOONH4��s��![]() CO��NH2��2��s����H2O��g�� ��H=��138kJ��mol��1
CO��NH2��2��s����H2O��g�� ��H=��138kJ��mol��1
��6��д����ҵ����NH3��CO2Ϊԭ�Ϻϳ����ص��Ȼ�ѧ����ʽ��_________________________��
��7��ijʵ��С��ģ�ҵ�Ϻϳ����ص���������һ���Ϊ0.5 L���ܱ�������Ͷ��4 mol����1mol������̼��ʵ���÷�Ӧ�и���ֵ����ʵ�����ʱ��ı仯����ͼ��ʾ��
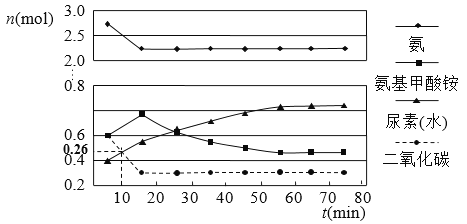
�ٷ�Ӧ���е�10 minʱ���CO2�����ʵ�����ͼ��ʾ������CO2��ʾ�ĵ�һ����Ӧ������v��CO2����
mol/��L��min����
����֪�ܷ�Ӧ�Ŀ���������һ����������ϳ������ܷ�Ӧ�Ŀ����ɵ�_________����Ӧ�������ܷ�Ӧ���е�_________minʱ����ƽ�⡣
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£���a mol N2��b mol H2�Ļ������ͨ��һ���̶��ݻ����ܱ������У��������·�Ӧ��N2 ��g�� �� 3H2��g��![]() 2NH3��g��
2NH3��g��
��1������Ӧijʱ��tʱ��n t ��N2�� = 13 mol��n t ��NH3�� = 6 mol����a =__________mol��
��2����Ӧ��ƽ��ʱ�������������Ϊ716.8 L���������������NH3�ĺ��������������Ϊ25%��ƽ��ʱNH3�����ʵ���__________��
��3��ԭ���������ƽ��������������ʵ���֮����д����������ȡ���ͬ����
n��ʼ����n��ƽ�� =__________��
��4��ԭ��������У�a��b =__________��
��5���ﵽƽ��ʱ��N2��H2��ת����֮�ȣ�����N2���æ���H2��= __________��
��6��ƽ���������У�n��N2����n��H2����n��NH3�� =__________________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com