
����Ŀ��A��B��C����ǿ����ʣ�������ˮ�е�������������±���ʾ��
������ | Na����K����Cu2�� |
������ | SO��OH�� |
����ͼ��ʾװ���У��ס��ҡ��������ձ����ηֱ�ʢ��������A��Һ��������B��Һ��������C��Һ���缫��Ϊʯī�缫��

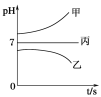
��ͨ��Դ������һ��ʱ�������ձ���c�缫����������16 g�������¸��ձ�����Һ��pH����ʱ��t�Ĺ�ϵ����ͼ���ݴ˻ش��������⣺
��1��MΪ��Դ��_____��(���������)���缫b�Ϸ����ĵ缫��ӦΪ__________________��
��2���缫e�����ɵ������ڱ�״̬�µ����Ϊ________��
��3��д�����ձ��еĵ��ط�Ӧ_______________________��
��4��Ҫʹ���ձ��е�C��Һ�ָ���ԭ����״̬����ȷ�IJ���__________�������������ݣ���
���𰸡���1���� 4OH����4e��===2H2O��O2�� ��2��5.6 L
��3��2CuSO4��2H2O![]() 2Cu��O2����2H2SO4
2Cu��O2����2H2SO4
��4������ձ��м���4.5 gˮ
��������
�����������ͨ��Դ������һ��ʱ��������c�缫����������16g������ӦΪCuSO4��Һ��cΪ������dΪ��������aΪ������bΪ������eΪ������fΪ������MΪ������NΪ�����������¸��ձ�����Һ��pH����ʱ��t�Ĺ�ϵͼ��ͼ2����pH��������ӦΪ�������ƻ�����������Һ������pH���䣬ӦΪ�����ƻ��������Һ����1�������Ϸ�����֪MΪ��������Ϊ����������ƻ�����������Һ��bΪ����������������Ӧ���缫����ʽΪ4OH����4e��=2H2O+O2������2��n��Cu��=![]() =0.25mol��ת�Ƶ���0.5mol����缫e������2H++2e��=H2����������n��H2��=0.25mol��v��H2��=0.25mol��22.4L/mol=5.6L��
=0.25mol��ת�Ƶ���0.5mol����缫e������2H++2e��=H2����������n��H2��=0.25mol��v��H2��=0.25mol��22.4L/mol=5.6L��
��3����ӦΪCuSO4��Һ�����ʱ����������ͭ������������������ⷽ��ʽΪ2CuSO4+2H2O![]() 2Cu+O2��+2H2SO4����4����Ϊ�����ƻ��������Һ��ʵ����Ϊ���ˮ��ת�Ƶ���0.5molʱ��2H2O
2Cu+O2��+2H2SO4����4����Ϊ�����ƻ��������Һ��ʵ����Ϊ���ˮ��ת�Ƶ���0.5molʱ��2H2O![]() 2H2��+O2��������ˮ�����ʵ���Ϊ0.25mol������Ϊ0.25mol��18g/mol=4.5g���ʴ�Ϊ��ˮ��4.5��
2H2��+O2��������ˮ�����ʵ���Ϊ0.25mol������Ϊ0.25mol��18g/mol=4.5g���ʴ�Ϊ��ˮ��4.5��


 ������״Ԫ��ҵϵ�д�
������״Ԫ��ҵϵ�д� ��ʱ�ƿ�������ϰϵ�д�
��ʱ�ƿ�������ϰϵ�д� һ��һ��һ��ͨϵ�д�
һ��һ��һ��ͨϵ�д� �㽭֮��ѧҵˮƽ����ϵ�д�
�㽭֮��ѧҵˮƽ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�¶�ʱ����һ��2L���ܱ������У�X��Y��Z�������ʵ����ʵ�����ʱ��ı仯������ͼ��ʾ������ͼ�����ݣ�����д���пհף�
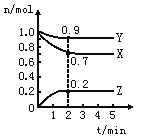
��1���÷�Ӧ�Ļ�ѧ����ʽΪ ��
��2����Ӧ��ʼ��2min��������Z��ʾ��ƽ����Ӧ����Ϊ ��
��3����X��Y��Z��Ϊ���壬2min��Ӧ�ﵽƽ�⣬��Ӧ��ƽ��ʱ������ʱ��ϵ��ѹǿ�ǿ�ʼʱ�� ����
����ƽ��ʱ�������ڻ�������ƽ������������ʼͶ��ʱ_______ _____(��������������С�����������)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ݹ����ŵIJ�ͬ�������л�����з��ࡣ���������
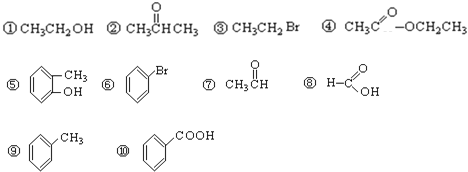
��1����������__________�� ��2��±������__________��
��3������__________�� ��4���ӣ�__________��
��5��ȩ��__________�� ��6��ͪ��__________��
��7�����__________����8������_________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������ס������������������ص�Ԫ�ء��ش��������⣺
��1��P�Ļ�̬ԭ��������Ӳ���е�ԭ�ӹ����Ϊ ��Fe3+��Fe2+�ȶ���ԭ���� ��
��2��N��O��P����Ԫ�ص�һ������������ ���縺�������� ��
��3������������NH4SCN��Һ�Ǽ���Fe3+�ij����Լ���SCN-��Cԭ�ӵ��ӻ�����Ϊ ��1mol SCN-�к���������ĿΪ NA��
��4��ijֱ���������Ƶ������ӳ���ͼ��ʾ��������״�ṹ����������������ͨ�����ж�����ԭ����������ö������ƵĻ�ѧʽΪ ��
![]()
��5��FeO��NiO�ľ���ṹ�����Ȼ��ƾ���ṹ��ͬ������Fe2+��Ni2+�����Ӱ뾶�ֱ�Ϊ7.8��10-2nm��6.9��10-2nm�����۵�FeO NiO�����������������=����ԭ���� ��
��6��������һ�ֳ�Ӳ��ĥ��Ϳ����ϣ��侧���ṹ��ͼ��ʾ��Pԭ����Bԭ�ӵ��������Ϊacm���������ı߳�Ϊ cm�����ú�a�Ĵ���ʽ��ʾ��

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ͼ��ʾ�����Թܷ���ʢ��25��ʱ����ʯ��ˮ���ձ��У��Թ��п�ʼ���뼸С��þƬ�����õιܵ���5ml�������Թ��У��Իش��������⣺
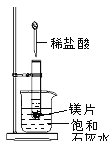
��1��ʵ���й۲쵽������ ��
��2�������������ԭ�� ��
��3��д���йط�Ӧ�����ӷ�Ӧ���� ��
��4���д���֪��MgCl2��Һ��H2�������� ��������������С����������������þƬ���������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��A��B��C��D���Ƕ�����Ԫ�أ�A��Bͬ���ڣ� B��Cͬ�壬AԪ������������������������Bԭ���������������ڲ�������Ķ�����B��A�����ɻ�����BA2��C��A���ɻ�����CA2�� A����������D�������ӵ��Ӳ�ṹ��ͬ��������ԭ�ӵĵ��Ӳ�ṹ��ͬ��D �ĵ�����A �ĵ����ڲ�ͬ�����·�Ӧ��������D2A��D2A2����ش�
��1��д��Ԫ�ط���B��_________ C��_________
��2��BA2�ĵ���ʽ _________ ��BA2�����л�ѧ������_________ ����
��3��D2A2�Ļ�ѧʽ _________ �������⻯��������_________ ɫ��
��4��C��Ԫ�����ڱ��е�λ���ǵ�_________���ڣ�_______�壬��ԭ�ӽṹʾ��ͼΪ________ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������и���ֱ����ĸ�Ӱ�컯ѧ��Ӧ�������صĹ�ϵ��Ϊ���У�
��1�������ʳƷ�ױ�ù���ڶ��첻���������� ��
��2��ͬŨ�Ȳ�ͬ����������з���ͬ����С��п���þ�飬���������п����� ��
��3��MnO2����˫��ˮ�зų����ݸ��� ��
������һ���¶��£�4L�ܱ�������ijһ��Ӧ������M������N�����ʵ�����ʱ��仯��������ͼ��
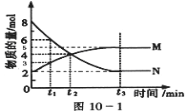
��1���Ƚ�t2ʱ�̣����淴Ӧ���ʴ�СV�� V����(������������=����������)
��2����t2=2min�����㷴Ӧ��ʼ��t2ʱ����M��Ũ�ȱ仯��ʾ��ƽ����Ӧ����Ϊ�� ��
��3��t3ʱ�̻�ѧ��Ӧ�ﵽƽ�⣬��Ӧ���ת����Ϊ ��
��4����������¶ȣ���V�� (������С��)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ѧ������ѧ�뼼�����������ƿ������ڸ��Ƶر�ˮ�ʡ��������ؽ������ӷ�ˮ�������ೱ��Ҳ������Ӧ�������ȡ�ʵ���ҿ��ù�ҵ̼���(��MgCO3��FeCO3������)��ȡ������̼��ƣ�Ȼ�����ô���̼�����ȡ�������ƣ�����Ҫ�������£�
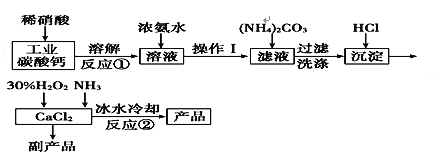
��֪��CaO2��8H2O�ʰ�ɫ����ˮ��������350�����ҿ�ʼ�ֽ�ų�������425���ֽ���ȫ��
��1��д����Ӧ����������ԭ��Ӧ�����ӷ���ʽ��___________________________��
��2����Ӧ�������Һ�м�Ũ��ˮ��Ŀ���ǣ�___________��________(�÷���ʽ��ʾ)
��3����Ӧ�����ñ�ˮ�����¶���0�����ң������ԭ����(д������)��
��__________________________����__________________________��
��4���ⶨ��Ʒ��CaO2�ĺ�����ʵ�鲽����
��һ����ȷ��ȡa g��Ʒ��������ƿ�У�������������ˮ������b g KI���壬�ٵ�������2 mol/L��H2SO4��Һ����ַ�Ӧ��
�ڶ�������������ƿ�м��뼸�ε�����Һ��
����������μ���Ũ��Ϊc mol��L��1��Na2S2O3��Һ����Ӧ��ȫ������Na2S2O3��ҺV mL����֪��I2��2S2O===2I����S4O��
ijͬѧ��һ���͵ڶ����IJ������ܹ淶������������̫����������õ�CaO2��������������________(�����Ӱ�족��ƫ�͡���ƫ�ߡ�)��ԭ����____________________.
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪Ksp��AgCl����1.56��10-10��Ksp��AgBr����7.7��10-13 ��Ksp��Ag2CrO4����9��10-11��ij��Һ�к���Cl-��Br-��CrO42-��Ũ�Ⱦ�Ϊ0.010mol/L�������Һ����μ���0.010mol/L��AgNO3��Һʱ�����������Ӳ����������Ⱥ�˳��Ϊ ( )
A��Cl-��Br-��CrO42- B��CrO42-��Br��Cl- C��Br-��Cl-��CrO42- D��Br��CrO42-��Cl-
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com