
【题目】A、B、C、D均是短周期元素,A和B同周期, B和C同族,A元素族序数是周期数的三倍,B原子最外层电子数是内层电子数的二倍,B与A能生成化合物BA2,C与A生成化合物CA2, A的阴离子与D的阳离子电子层结构相同,都与氖原子的电子层结构相同,D 的单质与A 的单质在不同条件下反应,可生成D2A或D2A2。请回答
(1)写出元素符号B:_________ C:_________
(2)BA2的电子式 _________ ,BA2分子中化学键属于_________ 键。
(3)D2A2的化学式 _________ ,灼烧这化合物火焰呈_________ 色。
(4)C在元素周期表中的位置是第_________周期,_______族,其原子结构示意图为________ 。
【答案】(1)C; Si
(2)![]() (极性)共价
(极性)共价
(3)Na2O2黄
(4)三 ⅣA![]()
【解析】试题分析:A、B、C、D均是短周期元素,A元素族序数是周期数的三倍,A只能处于第二周期,族序数为Ⅵ,故A为O元素;A和B同周期,B原子最外层电子数是内层电子数的二倍,最外层电子数为4,则B为C元素;B和C同族,则C为Si;A的阴离子与D的阳离子电子层结构相同,都与氖原子的电子层结构相同,D的单质与A的单质在不同条件下反应,可生成D2A或D2A2,则D为Na,
(1)由上述分析可知,B为C元素,C为Si元素,故答案为:C;Si;
(2)CO2分子中碳原子与氧原子之间形成2对共用电子对,电子式为![]() ,CO2分子中化学键属于共价键,故答案为:
,CO2分子中化学键属于共价键,故答案为:![]() ;共价;
;共价;
(3)D为Na元素,A为O元素,D2A2的化学式为Na2O2,故答案为:Na2O2;
(4)C为Si,在元素周期表中的位置是第三周期ⅣA族,其原子结构示意图为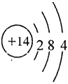 ,故答案为:三;ⅣA;
,故答案为:三;ⅣA; .
.


 习题精选系列答案
习题精选系列答案科目:高中化学 来源: 题型:
【题目】金刚烷是一种重要的化工原料,如合成的金刚烷胺就是一种抗病毒药剂,对帕金森症有良好的疗效。由环戊二烯合成金刚烷的路线如下:
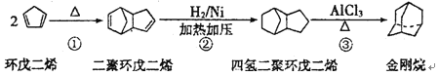
请回答下列问题:
(1)金刚烷的分子式为_______________________。
(2)反应①的反应类型是______________________。
(3)金刚烷与四氢二聚环戊二烯的关系是_____________(填字母)。
a.互为同系物 b.互为同分异构体 c.均为烷烃 d.均为环烃
(4)下面是以环戊烷为原料制备环戊二烯的合成路线:
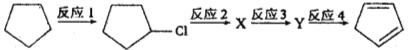
其中, X的名称是______________;
(5)反应4的化学方程式是_____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 用NA表示阿伏加德罗常数的值。下列叙述正确的是
A.1.8 g重水(D2O)中含NA个中子
B.标准状况下,2.24 L Cl2与过量稀NaOH溶液反应,转移的电子总数为0.2 NA
C.室温下,21.0 g乙烯和丁烯的混合气体中含有的碳原子数目为1.5 NA
D.足量的铜与含2 mol H2SO4的浓硫酸充分反应,可生成NA个SO2分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)25℃时,在等体积的 ① pH=0的H2SO4溶液、② 0.05 mol/L的Ba (OH)2溶液、③ pH=10的Na2S溶液、④ pH=5的NH4NO3溶液中,发生电离的水的物质的量之比 。
(2)常温下,0.2mol/LCH3COOH溶液与0.1mol/LNaOH溶液等体积混合后:
c(CH3COO) + c(CH3COOH)= mol/L
c(H+) c(CH3COO) - c(CH3COOH) +2c(OH) (填“>”、“<”或“=”)
(3)常温下,把pH=11的氢氧化钠溶液与pH=3的醋酸溶液等体积混合,在所得溶液中离子浓度大小关系是 。
(4)常温下,把pH=2的H2SO4和pH=11的NaOH溶液混和,混和液pH=7。则两溶液的体积比是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C三种强电解质,它们在水中电离出的离子如下表所示:
阳离子 | Na+、K+、Cu2+ |
阴离子 | SO、OH- |
在下图所示装置中,甲、乙、丙三个烧杯依次分别盛放足量的A溶液、足量的B溶液、足量的C溶液,电极均为石墨电极。

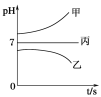
接通电源,经过一段时间后,测得乙烧杯中c电极质量增加了16 g。常温下各烧杯中溶液的pH与电解时间t的关系如上图。据此回答下列问题:
(1)M为电源的_____极(填“正”或“负”),电极b上发生的电极反应为__________________。
(2)电极e上生成的气体在标准状态下的体积为________。
(3)写出乙烧杯中的电解池反应_______________________。
(4)要使丙烧杯中的C溶液恢复到原来的状态,正确的操作__________(计算出相关数据)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T所处的周期序数与主族序数相等,请回答下列问题:
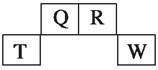
(1)T元素的离子结构示意图为__________。
(2)元素的非金属性(原子得电子的能力):Q ________W(填“强于”或“弱于”)。
(3)W的单质与其最高价氧化物的水化物浓溶液共热能发生反应,生成两种物质,其中一种是气体,该反应的化学方程式为_________________________________________
(4)原子序数比R多1的元素的一种氢化物能分解为它的另一种氢化物,此分解反应的化学方程式是_________________________________________________________其反应物的电子式为 。离子半径T3+__________R3-(填“>”、“<”、“=”)
(5)R有多种氧化物,其中甲的相对分子质量最小。在一定条件下,2 L的甲气体与0.5 L的氧气相混合,若该混合气体被足量的NaOH溶液完全吸收后没有气体残留,所生成的R的含氧酸盐只有一种,则该含氧酸盐的化学式是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】K2Cr2O7溶液中存在平衡:Cr2O72-(橙色)+H2O![]() 2CrO42-(黄色)+2H+。用K2Cr2O7溶液进行下列实验:
2CrO42-(黄色)+2H+。用K2Cr2O7溶液进行下列实验:
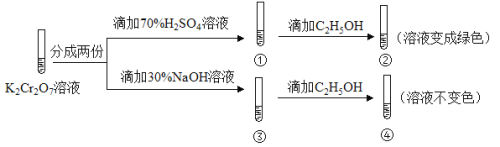
结合实验,下列说法不正确的是
A.①中溶液橙色加深,③中溶液变黄
B.②中Cr2O72-被C2H5OH还原
C.对比②和④可知K2Cr2O7酸性溶液氧化性强
D.若向④中加入70%H2SO4溶液至过量,溶液变为橙色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积为2 L的密闭容器中进行如下反应:A(g)+2B(g) ![]() 3C(g)+nD(g),开始时A为4 mol,B为6 mol,5 min末时测得C的物质的量为3 mol,用D表示的化学反应速率v(D)为0.2 mol/(L·min)。计算:
3C(g)+nD(g),开始时A为4 mol,B为6 mol,5 min末时测得C的物质的量为3 mol,用D表示的化学反应速率v(D)为0.2 mol/(L·min)。计算:
(1)5 min末A的物质的量浓度为 。
(2)前5 min内用B表示的化学反应速率v(B)为 。
(3)化学方程式中n值为 。
(4) 5min后A的转化率为 。
(5)此反应在四种不同情况下的反应速率分别为:
①v(A)=5 mol/(L·min) ②v(B)= 6 mol/(L·min)
③v(C)=4.5 mol/(L·min) ④v(D)=8 mol/(L·min)
其中反应速率最快的是 (填编号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲苯是一种重要的化工原料,可以参与合成很多物质。下图为以甲苯为原料得到药物苯佐卡因的合成路线。
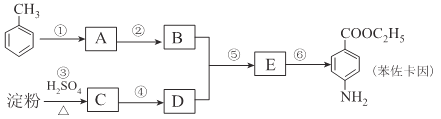
已知:i.苯环上连有甲基时,再引入其他基团主要进入甲基的邻位或对位;苯环上连有羧基时,再引入其他基团主要进入羧基的间位;
Ⅱ.![]() (有弱碱性,易被氧化)。
(有弱碱性,易被氧化)。
请回答下列问题:
(1)化合物C中官能团的结构简式为____________,检验反应③进行程度的试剂有____________。
(2)合成路线中反应类型属于取代反应的有____________个
(3)反应①的化学方程式为____________,该反应要控制好低温条件,否则会生成一种新物质F,该物质是一种烈性炸药,F的名称为____________。
(4)反应⑤的化学方程式为____________。
(5)甲苯的链状且仅含碳碳三键的同分异构体有____________种,其中满足下列条件的同分异构体的结构简式为____________。
①核磁共振氢谱只有两个吸收峰②峰面积之比为1:3
(6)化合物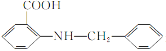 是一种药物中间体,请写出以甲苯为主要原料制备该中间体的合成路线流程图:
是一种药物中间体,请写出以甲苯为主要原料制备该中间体的合成路线流程图:
提示:①合成过程中无机试剂任选:②合成路线流程图示例如下:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com