
【题目】下列叙述正确的是
A.SiO2 既能和NaOH 溶液反应,又能和氢氟酸反应,所以SiO2属于两性氧化物
B.因为Na2CO3+SiO2![]() Na2SiO3+CO2↑,所以硅酸的酸性比碳酸强
Na2SiO3+CO2↑,所以硅酸的酸性比碳酸强
C.因为2C+SiO2![]() Si+2CO↑,所以非金属性C>Si
Si+2CO↑,所以非金属性C>Si
D.晶体硅可用作太阳能电池板或半导体材料,二氧化硅可做光导纤维
科目:高中化学 来源: 题型:
【题目】对于放热反应H2 + Cl2 ![]() 2HCl下列说法中正确的是
2HCl下列说法中正确的是
A. 该反应中,化学能只转变为热能
B. 反应物所具有的总能量高于产物所具有的总能量
C. 产物所具有的总能量高于反应物所具有的总能量
D. 断开1mol H-H键和1mol Cl-Cl键所吸收的总能量小于形成2mol H-Cl键所放出的能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将SO2通入BaCl2溶液至饱和的过程中,始终未观察到溶液中出现浑浊,若再通入另一种气体A,则产生白色沉淀。制备气体A的试剂不能是

A. 大理石和稀盐酸
B. NaOH和NH4Cl
C. Cu和浓硝酸
D. MnO2和浓盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含铬(![]() )废水用硫酸亚铁铵[FeSO4·(NH4)2SO4·6H2O]处理,反应中铁元素和铬元素完全转化为沉淀。该沉淀经干燥后得到nmol FeO·FeyCrxO3。不考虑处理过程中的实际损耗,下列叙述错误的是( )
)废水用硫酸亚铁铵[FeSO4·(NH4)2SO4·6H2O]处理,反应中铁元素和铬元素完全转化为沉淀。该沉淀经干燥后得到nmol FeO·FeyCrxO3。不考虑处理过程中的实际损耗,下列叙述错误的是( )
A. 消耗硫酸亚铁铵的物质的量为n(2-x)mol
B. 处理废水中![]() 的物质的量为
的物质的量为![]() mol
mol
C. 反应中发生转移的电子数为3nxmol
D. 在FeO· FeyCrxO3中,3x=y
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜是重要的工业原料,现有![]() 、
、![]() 组成的混合物,某研究性学习小组为了探究其组成情况,取
组成的混合物,某研究性学习小组为了探究其组成情况,取![]() 该混合物加入
该混合物加入![]() 的稀硝酸中,固体物质完全反应,生成
的稀硝酸中,固体物质完全反应,生成![]() (标准状况)的
(标准状况)的![]() 。向所得溶液中加入
。向所得溶液中加入![]() 的
的![]() 溶液,恰好使溶液中的
溶液,恰好使溶液中的![]() 沉淀完全。
沉淀完全。
(1)![]() 与稀硝酸反应的化学方程式为____________。
与稀硝酸反应的化学方程式为____________。
(2)混合物中,![]() ______;
______;![]() ________。
________。
(3)![]() ______
______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列描述中正确的是( )
A. CS2 为空间构型为V形的极性分子
B. 双原子或多原子形成的气体单质中,一定有σ键,可能有π键
C. 氢原子电子云的一个小黑点表示一个电子
D. HCN、SiF4和SO32﹣ 的中心原子均为sp3杂化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨及其相关工业中,部分物质间的转化关系如下:

下列说法不正确的是
A. 甲、乙、丙三种物质都含有氮元素 B. 反应Ⅱ、Ⅲ和Ⅳ的氧化剂相同
C. Ⅵ的产物可在上述流程中被再次利用 D. 丁为NaHCO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E代表前四周期原子序数依次增大的五种元素。A、D同主族且A原子的2p轨道上有1个电子的自旋方向与其它电子的自旋方向相反;工业上电解熔融C2A3制取单质C;B、E除最外层均只有2个电子外,其余各层全充满。回答下列问题:
(1)B、C中第一电离能较大的是__ (用元素符号填空),基态E原子价电子的轨道表达式______。
(2)DA2分子的VSEPR模型是_____。
(3)实验测得C与氯元素形成化合物的实际组成为C2Cl6,其球棍模型如图所示。已知C2Cl6在加热时易升华,与过量的NaOH溶液反应可生成Na[C(OH)4]。
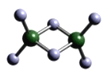
①C2Cl6属于_______晶体(填晶体类型),其中C原子的杂化轨道类型为________杂化。
②[C(OH)4]-中存在的化学键有________。
a.离子键 b.共价键 c.σ键 d.π键 e.配位键 f.氢键
(4)B、C的氟化物晶格能分别是2957 kJ/mol 、5492 kJ/mol,二者相差很大的原因________。
(5)D与E形成化合物晶体的晶胞如下图所示:
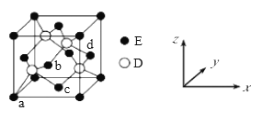
①在该晶胞中,E的配位数为_________。
②原子坐标参数可表示晶胞内部各原子的相对位置。上图晶胞中,原子的坐标参数为:a(0,0,0);b(![]() ,0,
,0,![]() );c(
);c(![]() ,
,![]() ,0)。则d原子的坐标参数为______。
,0)。则d原子的坐标参数为______。
③已知该晶胞的边长为x cm,则该晶胞的密度为ρ=_______g/cm3(列出计算式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ. ![]() U是重要的核工业原料,在自然界的丰度很低。
U是重要的核工业原料,在自然界的丰度很低。![]() U的浓缩一直为国际社会关注。回答下列有关问题:
U的浓缩一直为国际社会关注。回答下列有关问题:
(1)![]() U的中子数是___。
U的中子数是___。
(2)![]() U、
U、![]() U、
U、![]() U互为同位素,下列对同位素的理解不正确的是___(填序号,下同)。
U互为同位素,下列对同位素的理解不正确的是___(填序号,下同)。
A.元素符号相同 B.物理性质相同 C.化学性质基本相同 D.在周期表中位置相同
(3)下列有关![]() U说法不正确的是___。
U说法不正确的是___。
A.![]() U原子核内中子数与质子数之差为51
U原子核内中子数与质子数之差为51
B.![]() U与
U与![]() U的质子数、电子数都相等
U的质子数、电子数都相等
C.![]() U与
U与![]() U是两种质子数相同,中子数不同的原子
U是两种质子数相同,中子数不同的原子
D. ![]() U与
U与![]() U是同种原子
U是同种原子
Ⅱ.锂的材料在社会生活中广泛应用,如亚氨基锂(Li2NH)是一种储氢容量高、安全性好的固体储氢材料,LiCoO2用作便携式电源的正极材料,碳酸锂(Li2CO3)广泛应用于陶瓷和医药等领域。根据下列要求回答相关问题:
(1)![]() Li和
Li和![]() Li用作核反应堆最佳载热体,
Li用作核反应堆最佳载热体,![]() LiH和
LiH和![]() LiD用作高温堆减速剂。下列说法中正确的是_______(填序号,下同)。
LiD用作高温堆减速剂。下列说法中正确的是_______(填序号,下同)。
A. ![]() Li和
Li和![]() Li互为同位素 B
Li互为同位素 B![]() Li和
Li和![]() Li属于同种核素
Li属于同种核素
C.![]() LiH和
LiH和![]() LiD的化学性质不同 D.
LiD的化学性质不同 D.![]() LiH和
LiH和![]() LiD是同种物质
LiD是同种物质
(2)下列说法不正确的是_________。
A.碱性:Be(OH)2<LiOH<NaOH<KOH B.半径:K>Na>Li>Li+
C.氧化性:Li+<Na+<K+<Rb+<Cs+ D.金属性:Cs>Rb>K>Na>Li>Be
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com