

图3-2
(1)假设甲烷与氯气反应充分,且只产生一种有机物,请写出化学方程式_______________。
(2)经过几个小时的反应后,U形管右端的玻璃管中水柱变化是( )
A.升高 B.降低 C.不变 D.无法确定
(3)U形管左端的气柱变化是( )
A.体积增大 B.体积减小 C.消失 D.不变
(4)试解释U形管右端的玻璃管中水柱变化的原因____________________________________。
解析:(1)甲烷和氯气在光照的条件下发生取代反应:CH4+4Cl2![]() CCl4+4HCl;
CCl4+4HCl;
(2)甲烷和氯气在光照的条件下发生取代反应,U形管左侧生成的氯化氢气体易溶于水,压强减小,U形管右侧液面下降。
(3)甲烷和氯气在光照的条件下发生取代反应,U形管左侧生成的氯化氢气体易溶于水,压强减小,气柱体积减小。
(4)反应中气体的物质的量减少,且生成的HCl能够溶于水,所以左侧压强减小至零,故右侧玻璃管中的水柱降低,左侧气柱消失。
答案:(1)CH4+4Cl2![]() CCl4+4HCl
CCl4+4HCl
(2)B
(3)BC(注意:体积消失是体积减小的极限)
(4)由上述化学方程式可知此反应中气体的物质的量减少,且生成的HCl能够溶于水,所以左侧压强减小至零,故右侧玻璃管中的水柱降低,左侧气柱消失


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:阅读理解
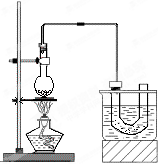 、实验室制备溴乙烷(C2H5Br)的装置和步骤如图:(已知溴乙烷的沸点38.4℃)
、实验室制备溴乙烷(C2H5Br)的装置和步骤如图:(已知溴乙烷的沸点38.4℃)| △ |
| △ |
| 醇 |
| △ |
| 醇 |
| △ |
| 醇 |
| △ |
| 醇 |
| △ |
查看答案和解析>>
科目:高中化学 来源: 题型:
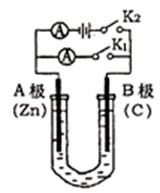 如右图所示,U形管内盛有100mL的溶液,按要求回答下列问题:
如右图所示,U形管内盛有100mL的溶液,按要求回答下列问题:查看答案和解析>>
科目:高中化学 来源:2011届四川省南充高中高三第四次月考化学试卷 题型:实验题
某研究性学习小组进行溴乙烷的制备及性质探究实验。
探究一:该小组制备溴乙烷的步骤如下:
① 向装置图所示的U形管和大烧杯中加入冷水;
② 在小烧杯中按照一定比例配制乙醇、水、浓硫酸的混合液;
③ 向装置图所示的圆底烧瓶中加入一定量研细的溴化钠粉末和少量碎瓷片;
④ 将冷却至室温的混合液转移到圆底烧瓶中,加热;
⑤ 制取溴乙烷。
回答下列问题:
(1)步骤②向乙醇和水中缓缓加入浓硫酸时,小烧杯要置于冷水中冷却,除了避免硫酸小液滴飞溅外,更主要的目的是:_____________________________________
(2)步骤④加热片刻后,烧瓶内的混合物出现橙红色,出现这种现象的原因是(请用化学反应方程式表示):____________________________________________________
改用小火加热后,橙红色会逐渐消失,消失的原因是(请用化学反应方程式表示):
______________________________________________________
(3)为了更好地控制反应温度,除用图示的小火加热,还可采用的加热方式是__________。
(4)步骤⑤反应结束后,将U形管中的混合物倒入分液漏斗中,静置,待液体分层后, 弃去____________(填“上层”或“下层”)液体。为了除去粗产品中的杂质,可用下列试剂中的_____________(填序号)
| A.氢氧化钠稀溶液 | B.碳酸钠稀溶液 |
| C.硝酸银溶液 | D.四氯化碳 |

查看答案和解析>>
科目:高中化学 来源:2013届浙江省高二上学期期中考试化学(理)试卷 题型:填空题
如右图所示,U形管内盛有100mL的溶液,按要求回答下列问题:
(1)打开K2 ,合并K1 ,若所盛溶液为CuSO4溶液:则A为 极,A极的电极反应式为 。若所盛溶液为KCl溶液:则B极的电极反应式为 , K+移向 极(填A、B)
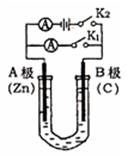
(2)打开K1,合并K2,若所盛溶液为滴有酚酞的NaCl溶液,则:①A电极附近可观察到的现象是 。
②B电极上的电极反应式为 ,总反应化学方程式是 。
③反应一段时间后打开K2 , 若忽略溶液的体积变化和气体的溶解,B极产生气体的体积(标准状况)为11.2mL, 将溶液充分混合,溶液的pH约为 。若要使电解质溶液恢复到原状态,需向U形管内加入或通入一定量的 。
(3)如要用电解方法精炼粗铜,打开K1,合并K2,电解液选用CuSO4溶液,则A电极的材料应换成是 ,电极反应式是 ,反应一段时间后电解质溶液中Cu2+浓度 (填“增大”、“减小”、“不变”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com