
【题目】常温下,用 NaOH溶液滴定NH4HSO4溶液 ,混合溶液的相对导电能力变化曲线如图所示,已知: Kb(NH3 H2O) =10-5,下列叙述正确的是
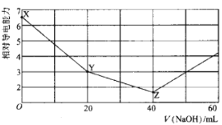
A.X→Y 过程中发生反应的离子方程式为:![]() +OH-= NH3 H2O
+OH-= NH3 H2O
B.Y点满足:c(![]() ) +c(Na+) =2c(
) +c(Na+) =2c(![]() )
)
C.水的电离程度:X>Y>Z
D.若Z点溶液pH=1l,则此时溶液中氨水浓度约为0.1 molL-1
【答案】D
【解析】
从图中可知,Z点时溶液的导电能力最弱,表明此时NH4HSO4与NaOH刚好完全反应,生成Na2SO4和NH3 H2O;则X→Y过程中只发生H++OH-=H2O,溶质为NaNH4SO4。
A.NH4HSO4溶液中滴加NaOH溶液,H+与OH-先发生反应,![]() 与OH-后发生反应,X→Y过程中发生反应的离子方程式为:H++OH-=H2O,A不正确;
与OH-后发生反应,X→Y过程中发生反应的离子方程式为:H++OH-=H2O,A不正确;
B.Y点时,溶质为NaNH4SO4,pH<7,满足电荷守恒:c(![]() ) +c(Na+) + c(H+) =2c(
) +c(Na+) + c(H+) =2c(![]() )+c(OH-),由于c(H+)> c(OH-),所以c(
)+c(OH-),由于c(H+)> c(OH-),所以c(![]() ) +c(Na+)<2c(
) +c(Na+)<2c(![]() ),B不正确;
),B不正确;
C.X点溶质为NH4HSO4溶液,硫酸氢铵电离出的H+将抑制水的电离,Y点溶质为NaNH4SO4,因![]() 水解促进水的电离,Z点溶质为Na2SO4和NH3 H2O,水的电离受到抑制,但比X点对水的抑制作用弱,所以水的电离程度:Y>Z >X,C不正确;
水解促进水的电离,Z点溶质为Na2SO4和NH3 H2O,水的电离受到抑制,但比X点对水的抑制作用弱,所以水的电离程度:Y>Z >X,C不正确;
D.若Z点溶液pH=1l,则此时溶液中发生一水合氨的电离:NH3·H2O![]()
![]() +OH-,则Kb=
+OH-,则Kb=![]() ,即
,即![]() =10-5,氨水浓度约为0.1 molL-1,D正确;
=10-5,氨水浓度约为0.1 molL-1,D正确;
故选D。


科目:高中化学 来源: 题型:
【题目】研究人员采用双极膜将酸-碱电解液隔离,实现MnO2/Mn2+和Zn/![]() 的两个溶解/沉积电极氧化还原反应,研制出新型高比能液流电池,其放电过程原理示意图如下:
的两个溶解/沉积电极氧化还原反应,研制出新型高比能液流电池,其放电过程原理示意图如下:
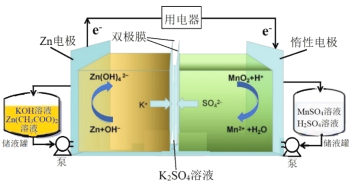
下列说法不正确的是
A.放电过程中,总反应方程式为Zn+MnO2+4OH-+4H+===![]() +Mn2++2H2O
+Mn2++2H2O
B.放电过程中,当1molZn参与反应时,理论上有4molK+发生迁移
C.充电过程中,阴极的电极反应为![]() +2e-===Zn+4OH-
+2e-===Zn+4OH-
D.充电过程中,右侧池中溶液pH逐渐减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D在一定条件下的转化关系如图所示(反应条件已省略)。其中,A是一种气态烃,在标准状况下的密度是1.25 g·L-1,其产量是衡量一个国家石油化工发展水平的标志;C的分子式为C2H4O2;B和C在浓硫酸和加热的条件下发生反应,生成的有机物D有特殊的香味。
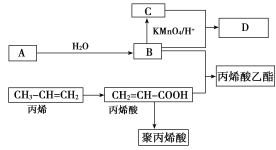
试回答下列问题:
(1)A的分子式为________,丙烯酸分子结构中所含的官能团名称是________,丙烯分子中最多有________个原子共平面。
(2)丙烯酸乙酯可能发生的反应类型有________。
①加成反应 ②取代反应 ③加聚反应 ④中和反应
A.①③ B.①②③
C.①③④ D.①②③④
(3)写出聚丙烯酸的结构简式________。
(4)写出丙烯酸与B反应的化学方程式_________________________________________________。
(5)下列有关说法正确的是________(填编号)。
A.D与丙烯酸乙酯互为同系物
B.B→C的转化是氧化反应
C.可以用酸性KMnO4溶液鉴别A和丙烯酸
D.蒸馏能分离B和C的混合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】香料甲和G都在生活中有很多用途,其合成路线如下:

已知:①R1—CHO+R2—CH2—CHO![]()
![]() (R1、R2代表烃基或氢原子)
(R1、R2代表烃基或氢原子)
②D与A互为同系物;在相同条件下,D蒸气相对于氢气的密度为39。
(1)A的名称是____,G中含氧官能团的名称是____。
(2)②的反应类型是____,B和F的结构简式分别为______、______。
(3)写出一种能鉴别A和D的试剂:______;C有多种同分异构体,其中属于芳香族化合物的有____种。
(4)写出反应①的化学方程式:_____________。
(5)G的同分异构体 是一种重要的药物中间体,其合成路线与G相似,请以
是一种重要的药物中间体,其合成路线与G相似,请以![]() 为原料设计它的合成路线(其他所需原料自选)_________。
为原料设计它的合成路线(其他所需原料自选)_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验小组同学探究NH3与Cl2的反应,装置如图所示。常温常压下,将氨气收集在薄膜保鲜袋(无弹性)中,氯气收集在反应管中,关闭K,按图连接好装置;将氨气压入反应管,充分反应后打开K。下列说法错误的是

A.反应开始后,保鲜袋逐渐被吸入反应管
B.反应过程中,反应管中产生白烟
C.打开K后,水会倒吸入反应管
D.上述反应原理可用于检验输送氯气的管道是否泄漏
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量的二氧化硫和含0.7 mol氧气的空气(忽略CO2)放入一定体积的密闭容器中,550℃时,在催化剂作用下发生反应2SO2+O2![]() 2SO3。反应达到平衡后,将容器中的混合气体通过过量氢氧化钠溶液,气体体积减小了21.28 L;再将剩余气体通过一种碱性溶液吸收氧气,气体的体积又减少了5.6 L(以上气体体积均为标准状况下的体积)。(计算结果保留一位小数)请回答下列问题:
2SO3。反应达到平衡后,将容器中的混合气体通过过量氢氧化钠溶液,气体体积减小了21.28 L;再将剩余气体通过一种碱性溶液吸收氧气,气体的体积又减少了5.6 L(以上气体体积均为标准状况下的体积)。(计算结果保留一位小数)请回答下列问题:
(1)判断该反应达到平衡状态的标志是(填字母)__________________。
a.二氧化硫和三氧化硫浓度相等
b.三氧化硫百分含量保持不变
c.容器中气体的压强不变
d.三氧化硫的生成速率与二氧化硫的消耗速率相等
e.容器中混合气体的密度保持不变
(2)求该反应达到平衡时,消耗二氧化硫的物质的量占原二氧化硫的物质的量的百分比____。
(3)若将平衡混合气体的5%通入过量的氯化钡溶液中,生成沉淀的质量是多少?______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列热化学方程式中,正确的是( )
A.甲烷的燃烧热为890.3kJ·mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H=-890.3kJ·mol-1
B.500℃、30MPa下,将 0.5molN2(g)和1.5molH2(g)置于密闭容器中充分反应生成 NH3(g)放热19.3kJ,其热化学方程式为:N2(g)+3H2(g)![]() 2NH3(g) △H = -38.6kJ·mol-1
2NH3(g) △H = -38.6kJ·mol-1
C.HCl 和 NaOH 反应的中和热△H=-57.3 kJ·mol-1 ,则H2SO4和Ba(OH)2反应的中和热 △H = 2×(-57.3)kJ·mol -1
D.在101kPa 时,2gH2完全燃烧生成液态水,放出285.8kJ热量,氢气燃烧的热化学方程式表示为2H2(g)+O2(g)=2H2O(1) △H =-571.6 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.环戊二烯(![]() )分子中所有原子共平面
)分子中所有原子共平面
B.同主族元素含氧酸的酸性随核电荷数的增加而减弱
C.二甲醚易溶于水,氨基乙酸的熔点较高,主要原因都与氢键有关
D.NO![]() 离子中心原子上的孤电子对数是0,立体构型为平面三角形
离子中心原子上的孤电子对数是0,立体构型为平面三角形
查看答案和解析>>
科目:高中化学 来源: 题型:
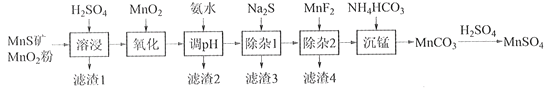
【题目】高纯硫酸锰作为合成镍钴锰三元正极材料的原料,工业上可由天然二氧化锰粉与硫化锰矿(还含Fe、Al、Mg、Zn、Ni、Si等元素)制备,工艺如下图所示。回答下列问题:
相关金属离子[c0(Mn+)=0.1 mol·L1]形成氢氧化物沉淀的pH范围如下:
金属离子 | Mn2+ | Fe2+ | Fe3+ | Al3+ | Mg2+ | Zn2+ | Ni2+ |
开始沉淀的pH | 8.1 | 6.3 | 1.5 | 3.4 | 8.9 | 6.2 | 6.9 |
沉淀完全的pH | 10.1 | 8.3 | 2.8 | 4.7 | 10.9 | 8.2 | 8.9 |
(1)“滤渣1”含有S和__________________________;写出“溶浸”中二氧化锰与硫化锰反应的化学方程式____________________________________________________。
(2)“氧化”中添加适量的MnO2的作用是将________________________。
(3)“调pH”除铁和铝,溶液的pH范围应调节为_______~6之间。
(4)“除杂1”的目的是除去Zn2+和Ni2+,“滤渣3”的主要成分是______________。
(5)“除杂2”的目的是生成MgF2沉淀除去Mg2+。若溶液酸度过高,Mg2+沉淀不完全,原因是_____________________________________________________________________。
(6)写出“沉锰”的离子方程式___________________________________________________。
(7)层状镍钴锰三元材料可作为锂离子电池正极材料,其化学式为LiNixCoyMnz2,其中Ni、Co、Mn的化合价分别为+2、+3、+4。当x=y=![]() 时,z=___________。
时,z=___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com