
【题目】下列热化学方程式中,正确的是( )
A.甲烷的燃烧热为890.3kJ·mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H=-890.3kJ·mol-1
B.500℃、30MPa下,将 0.5molN2(g)和1.5molH2(g)置于密闭容器中充分反应生成 NH3(g)放热19.3kJ,其热化学方程式为:N2(g)+3H2(g)![]() 2NH3(g) △H = -38.6kJ·mol-1
2NH3(g) △H = -38.6kJ·mol-1
C.HCl 和 NaOH 反应的中和热△H=-57.3 kJ·mol-1 ,则H2SO4和Ba(OH)2反应的中和热 △H = 2×(-57.3)kJ·mol -1
D.在101kPa 时,2gH2完全燃烧生成液态水,放出285.8kJ热量,氢气燃烧的热化学方程式表示为2H2(g)+O2(g)=2H2O(1) △H =-571.6 kJ·mol-1
【答案】D
【解析】
A. 燃烧热指的是1mol可燃物完全燃烧生成稳定的氧化物时放出的热量, H2O(g)应转化为液态水,故甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=890.3 kJmol1,故A错误;
B. 0.5mol N2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,因反应为可逆反应,则1molN2和3molH2置于密闭的容器中充分反应生成NH3(g),放热小于38.6kJ,则热化学反应方程式中的反应热数值错误,故B错误;
C. H2SO4和Ba(OH)2反应生成水外还生成硫酸钡沉淀,生成沉淀时继续放热,故C错误;
D. 2gH2为1mol,完全燃烧生成液态水,放出285.8kJ热量,可知2mol氢气燃烧放出571.6kJ的热量,则氢气燃烧的热化学方程式表示为 2H2(g)+O2(g)═2H2O(l)△H=571.6kJmol1,故D正确;
答案选D。


 学练快车道快乐假期寒假作业系列答案
学练快车道快乐假期寒假作业系列答案 新思维寒假作业系列答案
新思维寒假作业系列答案科目:高中化学 来源: 题型:
【题目】氧化还原反应的应用比较广泛。阅读下面的材料,结合相关化学知识回答下列问题。
(1)黑火药主要是硝酸钾、硫磺、木炭三者粉末的混合物,在点燃条件下,其化学反应式主要为:KNO3+S+C →N2↑+CO2↑+K2S
①在黑火药燃烧的反应中,氧化剂为____,被氧化的物质为____。
②根据化学反应式分析,一个硫原子参与反应时___(得到或失去)___个电子。
(2)把Cl2通入浓氨水中,发生如下反应:3Cl2 +8NH3=6NH4Cl +N2。用双线桥表示反应的电子转移方向和数目:____。
(3)已知存在下列反应:①ClO3-+5Cl-+6H+ =3Cl2+3H2O②2FeCl2+Cl2=2FeCl3。则ClO3- 、Fe3+ 、Cl2三种微粒氧化能力由强到弱的顺序是____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水合肼(N2H4·H2O)为无色透明的油状发烟液体,是一种重要的精细化工原料,其制备的反应原理为NaClO+2NH3===N2H4·H2O+NaCl。下列关于实验室制备水合肼的操作不正确的是( )
甲 乙
乙 丙
丙 丁
丁
A. 装置甲中试剂X可以选择生石灰 B. 装置乙作为反应过程的安全瓶
C. 装置丙制备水合肼时氨气从b口进入 D. 装置丁可用于吸收多余的尾气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸反应制取氢气时,下列措施不能使氢气生成速率加大的是( )
A. 对该反应体系加热
B. 不用稀硫酸,改用98%的浓硫酸
C. 滴加少量CuSO4溶液
D. 不用铁片,改用铁粉
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组依据反应AsO43-+2H++2I- AsO33-+I2+H2O设计左下图原电池,探究pH对AsO43-氧化性的影响。测得电压与pH的关系如右下图,下列有关叙述错误的是

A. pH>0.68时,甲烧杯中石墨为负极
B. pH=0.68时,反应处于平衡状态
C. pH>0.68时,氧化性I2>AsO43-
D. pH=5时,负极电极反应式为2I--2e-=I2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(I)工业上过氧化氢是重要的氧化剂和还原剂。常用于消毒、杀菌、漂白等。某化学兴趣小组的同学围绕过氧化氢开展了调查研究与实验,请你参与其中一起完成下列学习任务:
(1)该兴趣小组的同学查阅资料后发现H2O2为二元弱酸,其酸性比碳酸弱。请写出H2O2在水溶液中的电离方程式:____________________________。
(2)同学们用0.1000mol/L-1的酸性高锰酸钾标准溶液滴定某试样中过氧化氢的含量,反应原理为2MnO4-+5H2O2+6H+=2Mn2++8H2O+5O2↑。
①在该反应中,H2O2被_________(填“氧化”或“还原”)。
②滴定到达终点的现象是____________________________。
③用移液管吸取25.00mL试样置于锥形瓶中,重复滴定四次,每次消耗的酸性KMnO4标准溶液体积如下表所示:
第一次 | 第二次 | 第三次 | 第四次 | |
体积(mL) | 17.10 | 18.10 | 17.00 | 16.90 |
则试样中过氧化氢的浓度为__________mol/L-1。
(II)医学上常用酸性高锰酸钾溶液和草酸溶液的反应来测定血钙的含量。测定含量如下:取2mL血液用蒸馏水稀释后,向其中加入足量(NH4)2C2O4溶液,反应生成CaC2O4沉淀,将沉淀用稀疏酸溶解得到H2C2O4后,再用KMnO4溶液滴定。
(1)滴定时,用_____(填酸或碱)式滴定管装KMnO4溶液。
(2)下列操作会引起测定结果偏高的是______。
A.滴定管在盛装高锰酸钾前未润洗
B.滴定过程中,锥形瓶震荡的太剧烈,以致部分液体溅出
C.滴定前读数正确,滴定终点时俯视读数
D.锥形瓶未用待测液润洗
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1L稀硝酸和稀硫酸的混合液,其物质的量浓度分别为0.1mol/L和0.4mol/L。若向该混合溶液中加入足量的铜粉,从离子反应的角度分析,则最多能溶解铜粉的质量为( )
A. 9.6gB. 6.4 gC. 3.2 gD. 2.4 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生设计了一套验证物质化学性质的实验装置(如图):

请观察该装置图,完成下列问题:
(1)该实验的目的是________________________。
(2)该实验的涉及的化学方程式有___________________。
(3)实验用品:实验仪器除铁架台(带铁夹)、储气瓶(两个)、直管活塞(K1、K2)、止水夹(K3)、橡胶管、橡胶塞以及若干玻璃管连件外,还有哪几种(写仪器名称)_________________。
(4)实验步骤:①按上图连接好仪器装置;②扭开活塞K1和K2,主要现象为______________;③关闭________,(填写K1或K2或K3)打开________,(填写K1或K2或K3), 用手或热毛巾捂住圆底烧瓶,就能使烧瓶产生喷泉。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下列实验装置和方法进行相应实验,能达到实验目的的是
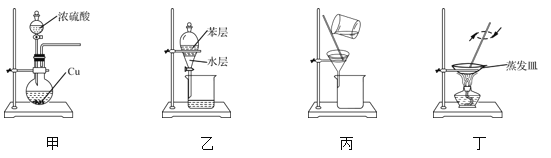
A. 用装置甲制备SO2
B. 用装置乙从碘水溶液中萃取碘
C. 用装置丙除去粗盐溶液中混有的KCl杂质
D. 用装置丁蒸干溶液获得(NH4)2CO3晶体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com