
【题目】一种气态烷烃和一种气态烯烃组成的混合物共11.6 g,混合气体的密度是相同状况下H2密度的14.5倍,该混合气体通过Br2水时,Br2水的质量增加8.4 g,则组成该混合气体的可能是( )
A.甲烷、乙烯 B.乙烷、乙烯 C.乙烷、丙烯 D.甲烷、丙烯
【答案】D
【解析】
试题分析:混合气体的密度是相同状况下H2密度的14.5倍,所以混合物的平均摩尔质量为14.5×2g/mol=29gmol-1,混合气体的总的物质的量为![]() =0.4mol,该混合气通过Br2水时,Br2水增重8.4g,8.4g为烯烃的质量,所以烷烃的质量为11.6g-8.4g=3.2g。若烷烃为甲烷,甲烷的物质的量为
=0.4mol,该混合气通过Br2水时,Br2水增重8.4g,8.4g为烯烃的质量,所以烷烃的质量为11.6g-8.4g=3.2g。若烷烃为甲烷,甲烷的物质的量为![]() =0.2mol,故烯烃的物质的量为0.4mol-0.2mol=0.2mol,所以M(烯烃)=
=0.2mol,故烯烃的物质的量为0.4mol-0.2mol=0.2mol,所以M(烯烃)=![]() =42gmol-1,为丙烯,若烷烃为乙烷,乙烷的物质的量为
=42gmol-1,为丙烯,若烷烃为乙烷,乙烷的物质的量为![]() =
=![]() mol,故烯烃的物质的量为0.4mol-
mol,故烯烃的物质的量为0.4mol-![]() mol=
mol=![]() mol,所以M(烯烃)=
mol,所以M(烯烃)= =28.6gmol-1,舍去,所以混合物为甲烷、丙烯,故选D。
=28.6gmol-1,舍去,所以混合物为甲烷、丙烯,故选D。


 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案科目:高中化学 来源: 题型:
【题目】盖斯定律指出:化学反应的反应热只与反应的始态和终态有关,而与具体反应进行的途径无 关。物质A在一定条件下可发生一系列转化,由图判断下列关系错误的是( )
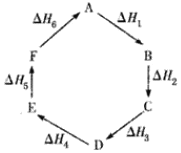
A.A→F:ΔH=-ΔH6
B.ΔH1+ΔH2+ΔH3+ΔH4+ΔH5+ΔH6=1
C.C→F:|ΔH|=|ΔH1+ΔH2+ΔH6|
D.|ΔH1+ΔH2+ΔH3|=|ΔH4+ΔH5+ΔH6|
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 乳酸薄荷醇酯(![]() )仅能发生水解、氧化、消去反应
)仅能发生水解、氧化、消去反应
B. 乙醛和丙烯醛(![]() )不是同系物,它们与氢气充分反应后的产物也不是同系物
)不是同系物,它们与氢气充分反应后的产物也不是同系物
C. 淀粉和纤维素在酸催化下完全水解后的产物都是葡萄糖
D. CH3COOCH2CH3与CH3CH2COOCH3互为同分异构体,1HNMR谱显示两者均有三种不同化学环境的氢原子且三种氢原子的比例相同,故不能用1HNMR来鉴别
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分。
碳 | 氮 | Y | |
X | 硫 | Z |
回答下列问题:
(1)X元素在周期表中的位置为 ,表中元素原子半径最小的是_________(填元素名称)。
(2)下列事实能说明Y元素的非金属性比S元素的非金属性强的是__________;
a. Y单质与H2S溶液反应,溶液变浑浊
b. 在氧化还原反应中,1molY单质比1molS得电子多
c. Y和S两元素的简单氢化物受热分解,前者的分解温度高
(3)表中某元素的气态氢化物与该元素的最高价氧化物对应的水化物可以反应,写出该反应的化学方程式为 。
(4)向盛有少量氢硫酸溶液的试管中通入二氧化硫气体,在实验结束后发现试管内壁上沾有黄色粉末,则清洗该试管的方法是 。
(5)已知元素Na与元素Y可形成原子个数比为1:1的二元离子化合物,写出该化合物的电子式 ,该化合物中的化学键类型有 。
(6)X与Z两元素的单质反应生成1molX的最高价化合物,恢复至室温,放热687kJ,已知该化合物的熔、沸点分别为-69℃和58℃,写出该反应的热化学方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化镁在医药、建筑等行业应用广泛。硫酸镁还原热解制备高纯氧化镁是一种新的探索。以菱镁矿(主要成分为MgCO3,含少量FeCO3 )为原料制备高纯氧化镁的实验流程如下:

生成氢氧化物沉淀的pH:
Mg(OH)2 | Fe(OH)2 | Fe(OH)3 | |
开始沉淀时 | 9.4 | 6.3 | 1.5 |
完全沉淀时 | 12.4 | 8.3 | 2.8 |
(1)MgCO3 与稀硫酸反应的离子方程式为_______________________。
(2)加双氧水的目的______________________;相关的离子方程式_________________________;加氨水调节溶液的PH范围为______________。
(3)滤渣2 的成分是_____________(填化学式)。
(4)煅烧过程存在以下反应:2MgSO4+C![]() 2MgO+2SO2↑+CO2↑
2MgO+2SO2↑+CO2↑
MgSO4+C![]() MgO+SO2↑+CO↑
MgO+SO2↑+CO↑
MgSO4+3C![]() MgO+S↑+3CO↑
MgO+S↑+3CO↑
利用下图装置对煅烧产生的气体进行分步吸收或收集。
①D中收集的气体可以是________________(填化学式)。
②B中盛放的溶液可以是________________(填字母)。
a.NaOH 溶液 b.Na2CO3 溶液 c.稀硝酸 d.KMnO4溶液
③A中得到的淡黄色固体与热的NaOH溶液反应,产物中元素最高价态为+4,写出该反应的离子方程式:__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaClO2是一种重要的杀菌消毒剂,也常用来漂白织物等,其一种生产工艺如下,回答下列问题:
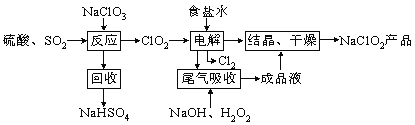
(1)ClO2的沸点为283K,纯ClO2易分解爆炸,一般用稀有气体或空气稀释到10%以下更安全。写出“反应”步骤中生成ClO2的化学方程式 。
(2)“尾气吸收”是吸收“电解”过程排出的少量ClO2。
①在尾气吸收过程中,可代替H2O2的试剂是 (填序号)。
A.Na2O2 B.Na2S C.FeCl2 D.KMnO4
②提高尾气的吸收效率的可行措施有 (填序号)。
A.尾气吸收时充分搅拌吸收液 B.适当加快尾气的通入速率
C.将温度控制在20℃以下 D.加水稀释尾气吸收液
③此吸收反应中,氧化剂与还原剂的物质的量之比为 。
(3)在碱性溶液中NaClO2比较稳定,在酸性溶液中,ClO2-和H+结合为HClO2,HClO2是唯一的亚卤酸,不稳定,易分解产生Cl2、ClO2和H2O,写出HClO2分解的化学方程式: 。
(4)已知NaClO2的溶解度随温度升高而增大,NaClO2饱和溶液在38℃以上60℃以下会析出NaClO2,在NaClO2析出过程中可能混有的杂质是 (填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质中各含有少量杂质,能用饱和Na2CO3溶液并借助于分液漏斗除去杂质的是
A. 苯中含有少量甲苯 B. 乙醇中含少量乙酸
C. 乙酸乙酯中含有少量乙酸 D. 溴苯中含有少量苯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定质量的甲烷燃烧后的产物为CO、CO2和水蒸气,此混合气体质量为41.6g,当其[缓慢经过无水CaCl2时,CaCl2增重21.6g。原混合气体中CO的质量为( )
A.11.2g B. 13.2 g C.8.8g D.20g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在不同温度下,水溶液中c(H+)与c(OH-)有如图所示关系。下列条件关于离子共存说法中正确的是( )

A. a点对应的溶液中大量存在:Fe3+、Na+、SCN-、SO42—
B. b点对应的溶液中大量存在:Na+、Fe3+、HCO3-、I-
C. c点对应的溶液中大量存在:Na+、Ca2+、Cl-、CO32—
D. d点对应的溶液中大量存在:Na+、K+、SO32—、Cl-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com