
【题目】使一镁铝合金粉末在过量稀H2SO4中溶解,在所得溶液中加入NaOH溶液,生成沉淀的质量w和加入NaOH溶液的体积V的关系如图所示,则该合金中镁和铝的质量之比为( ) 
A.2:3
B.1:1
C.4:3
D.8:9
【答案】D
【解析】解:生成沉淀与沉淀溶解两阶段消耗NaOH体积之比为(6﹣1):(7﹣6)=5:1,假设溶解氢氧化铝消耗NaOH为1mol,则生成沉淀消耗NaOH为5mol, Al(OH)3+NaOH=NaAlO2+2H2O
1mol 1mol
由Al元素守恒,可知m(Al)=1mol×27g/mol=27g,
生成1mol氢氧化铝消耗NaOH为1mol×3=3mol,则生成氢氧化镁消耗NaOH为5mol﹣3mol=2mol,则氢氧化镁为1mol,由Mg元素守恒,则m(Mg)=1mol×24g/mol=24g,
故该合金中镁和铝的质量之比为24g:27g=8:9,
故选D.
生成沉淀与沉淀溶解两阶段消耗NaOH体积之比为(6﹣1):(7﹣6)=5:1,假设溶解氢氧化铝消耗NaOH为1mol,则生成沉淀消耗NaOH为5mol,根据Al(OH)3+NaOH=NaAlO2+2H2O,计算氢氧化铝物质的量,再根据生成沉淀消耗NaOH计算氢氧化镁物质的量,根据元素守恒计算Mg、Al质量之比.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】在两个恒容的密闭容器中进行下列两个可逆反应:
甲:C(s)+H2O(g)![]() CO(g)+H2(g)
CO(g)+H2(g)
乙:CO(g)+H2O(g)![]() CO2(g)+H2(g)
CO2(g)+H2(g)
现有下列状态:①混合气体平均相对分子质量不再改变
②恒温时,气体压强不再改变 ③各气体组成浓度相等
④反应体系中温度保持不变 ⑤断裂氢氧键速率是断裂氢氢键速率的2倍 ⑥混合气体密度不变 ⑦单位时间内,消耗水蒸气质量与生成氢气质量比为9∶1
其中能表明甲、乙容器中反应都达到平衡状态的是( )
A. ①②⑤ B. ③④⑥ C. ⑥⑦ D. ④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下按如图安装好实验装置,在锥形瓶内盛6.5 g锌粒(颗粒大小基本相同),通过分液漏斗加入40 mL 2.5 mol·L-1的硫酸溶液,将产生的H2收集在一个注射器中,用时10 s时恰好收集到气体的体积为50 mL(若折合成0 ℃、101 kPa条件下的H2体积为44.8 mL),在该温度下,下列说法不正确的是( )

A. 可以通过测定锌粒减少质量来测定反应速率
B. 忽略锥形瓶内溶液体积的变化,用H+来表示10 s内该反应的速率为0.01 mol·L-1·s-1
C. 忽略锥形瓶内溶液体积的变化,用Zn2+来表示10 s内该反应速率为0.01 mol·L-1·s-1
D. 用H2来表示10 s内该反应的速率为0. 000 2 mol·s-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】气态烃A中碳元素与氢元素的质量比为6︰1.淀粉在一定条件下水解可生成B。B在人体组织中缓慢氧化,放出热量,提供生命活动所需能量。有关物质的转化关系如下图:
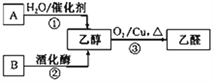
请回答:
(1)①的反应类型是_________________。
(2)向试管中加入2 mL10%氢氧化钠溶液,滴加4~5滴5%硫酸铜溶液,振荡后加入2 mL10% B溶液,加热。写出加热后观察到的现象_____________________________。
(3)反应③的化学方程式是__________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生的实验报告所列出的下列数据中合理的是 ( )
A. 用 10mL量筒量取 5.12mL 稀盐酸
B. 用广泛 pH 试纸测得某溶液 pH 为 3.2
C. 用 25mL 碱式滴定管,量取某碱溶液 20.50mL
D. 用托盘天平称取 10.50 gNaCl 固体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ可逆反应2SO2(g)+O2(g)===2SO3(g)是工业上制取H2SO4的重要反应。
(1)在恒压条件下,该反应分组实验的有关条件如下表:

已知Ⅰ、Ⅱ两组实验过程中,SO3气体的体积分数φ(SO3)随时间t的变化曲线如图所示

①Ⅱ组与Ⅰ相比不同的条件是________
②将Ⅰ组实验中温度变为800 ℃,则φ(SO3)达到a%所需时间________(填“小于”、“大于”或“等于”)t1
(2)向四个体积相同的密闭容器中分别充入一定量的SO2和O2,开始反应时,按反应速率由大到小排列顺序正确的是________
甲:在500 ℃时,10 mol SO2和10 mol O2反应
乙:在500 ℃时,用V2O5作催化剂,10 mol SO2和10 mol O2反应
丙:在450 ℃时,8 mol SO2和5 mol O2反应
丁:在500 ℃时,8 mol SO2和5 mol O2反应
A.甲、乙、丙、丁 B.乙、甲、丙、丁 C.乙、甲、丁、丙 D.丁、丙、乙、甲
Ⅱ 根据外界条件对化学平衡的影响回答下列问题:
(1)碘单质难溶于水却易溶于KI溶液。碘水中加入KI溶液发生反应:I2(aq)+I-(aq)![]() I3-(aq),下列说法不正确的是________(填字母序号,下同)。
I3-(aq),下列说法不正确的是________(填字母序号,下同)。
a.上述体系中加入苯,平衡不移动
b.可运用该反应原理除去硫粉中少量的碘单质
c.实验室配制碘水时,为增大碘单质的溶解度可加入适量KI溶液
d.加入AgNO3溶液平衡向左移动
(2)某温度下,体积一定的密闭容器中进行反应:N2(g)+3H2(g)![]() 2NH3(g) ΔH<0。
2NH3(g) ΔH<0。
①下列分析正确的是________。
a.平衡后,加入N2,该反应的ΔH增大
b.平衡后,加入催化剂,该反应的ΔH不变
c.平衡后,充入NH3,新平衡时,NH3的百分含量变大
d.若反应前充入的N2与H2物质的量相等,达平衡时N2的转化率比H2的高
②欲提高H2的转化率,下列措施可行的是________。
a.缩小容器体积
b.向容器中按原比例再充入N2和H2
c.向容器中再充入惰性气体
d.改变反应的催化剂
e.液化NH3并分离
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中小学生使用的涂改液中含有挥发性的有毒溶剂,应告诫学生不要使用,减少对身体的毒害及对环境的污染,该溶剂所含的一种有毒成份可能是( )
A. 三氯乙烯 B. 甘油 C. 乙醇 D. 乙酸
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com