
【题目】人们将连有四个不同基团的碳原子形象地称为手性碳原子。曙红可用作指示剂及染料,其结构简式如图所示。下列有关曙红的说法正确的是 ( )
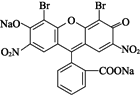
A.曙红不能与盐酸发生反应
B.1个曙红分子中含1个手性碳原子
C.1 mol曙红最多能与3 mol NaOH反应
D.曙红能发生取代、加成、消去反应
科目:高中化学 来源: 题型:
【题目】反应NH4Cl+NaNO2![]() NaCl+N2↑+2H2O放热且产生气体,可用于冬天石油开采。下列表示反应中相关微粒的化学用语正确的是
NaCl+N2↑+2H2O放热且产生气体,可用于冬天石油开采。下列表示反应中相关微粒的化学用语正确的是
A. 中子数为18的氯原子:![]()
B. N2的结构式:N=N
C. Na+的结构示意图: 
D. H2O的电子式: ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】大庆市某中学化学实验小组在实验室鉴定某无色溶液.已知溶液中的溶质仅由![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 中的若干种组成.取该溶液进行如下实验:
中的若干种组成.取该溶液进行如下实验:
![]() 取适量溶液,加入过量盐酸,有气体生成,并得到无色溶液
取适量溶液,加入过量盐酸,有气体生成,并得到无色溶液
![]() 在
在![]() 所得溶液中加入过量
所得溶液中加入过量![]() 溶液,有气体生成,同时产生白色沉淀甲;
溶液,有气体生成,同时产生白色沉淀甲;
![]() 在
在![]() 所得溶液中加入过量
所得溶液中加入过量![]() 溶液并加热也有气体生成,同时产生白色沉淀乙
溶液并加热也有气体生成,同时产生白色沉淀乙
则下列离子在原溶液中一定存在的有![]()
A.![]() 、
、![]() 、
、![]() B.
B.![]() 、
、![]() 、
、![]() 、
、![]() 、
、
C.![]() 、
、![]() 、
、![]() D.
D.![]() 、
、![]() 、
、![]() 、
、![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】恒温、恒压条件下,1 mol A和1 mol B在一个容积可变的容器中发生反应![]() ,一段时间后达到平衡状态,生成amol C。下列说法不正确的是( )
,一段时间后达到平衡状态,生成amol C。下列说法不正确的是( )
A.起始时和达到平衡状态时容器中的压强比为1:1
B.物质A、B的转化率之比一定是1:2
C.达到平衡状态时A的物质的量为![]()
D.当![]() 时,可断定反应达到平衡状态
时,可断定反应达到平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在一个2L的密闭容器中,加入4molA和 2molB进行如下反应:3A(g)+2B(g)![]() 4C(s)+2D(g)。反应一段时间后达到平衡,测得生成1.6molC,则下列说法正确的是( )
4C(s)+2D(g)。反应一段时间后达到平衡,测得生成1.6molC,则下列说法正确的是( )
A.该反应的化学平衡常数表达式是 K=![]()
B.此时,B的平衡转化率是40%
C.增大该体系的压强,平衡向右移动,化学平衡常数增大
D.增加 B,平衡向右移动,B的平衡转化率增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由CH3CH2CH2Br制备CH3CH(OH)CH2OH,依次发生的反应类型和反应条件都正确的是
选项 | 反应类型 | 反应条件 |
A | 加成、取代、消去 | KOH醇溶液/加热、KOH水溶液/加热、常温 |
B | 消去、加成、取代 | NaOH醇溶液/加热、常温、KOH水溶液/加热 |
C | 氧化、取代、消去 | 加热、KOH醇溶液/加热、KOH水溶液/加热 |
D | 消去、加成、水解 | NaOH水溶液/加热、常温、NaOH醇溶液/加热 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】检验某溶液中是否含有![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() ,限用的试剂有:盐酸、硫酸、硝酸银溶液、硝酸钡溶液。设计如下实验步骤,并记录相关现象。下列叙述不正确的是
,限用的试剂有:盐酸、硫酸、硝酸银溶液、硝酸钡溶液。设计如下实验步骤,并记录相关现象。下列叙述不正确的是![]()
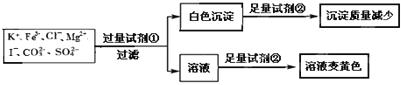
A.试剂![]() 为硝酸钡
为硝酸钡
B.试剂![]() 一定为盐酸
一定为盐酸
C.该溶液中一定有![]() 、
、![]() 、
、![]() 、
、![]()
D.通过在黄色溶液中加入硝酸银溶液可以检验原溶液中是否存在![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液可能含![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 中的几种离子.为了确定其成分,设计了如下实验;
中的几种离子.为了确定其成分,设计了如下实验;
![]() 取少量溶液于试管,滴加盐酸,观察到有大量气泡逸出,得到透明溶液;
取少量溶液于试管,滴加盐酸,观察到有大量气泡逸出,得到透明溶液;
![]() 在
在![]() 反应后的溶液中滴加硝酸银溶液,产生白色沉淀.
反应后的溶液中滴加硝酸银溶液,产生白色沉淀.
下列推断正确的是![]()
A.溶液中一定含![]() 、
、![]()
B.溶液中可能含![]() 、
、![]() 、
、
C.溶液中一定含![]() 、
、![]()
D.溶液中一定不含![]() 、
、![]() 、
、![]() 、
、
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁及其化合物与生产、生活关系密切。
(1)下图是实验室研究海水对铁闸不同部位腐蚀情况的剖面示意图。
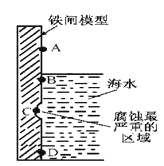
①该电化腐蚀称为__________________。
②图中A、B、C、D四个区域,生成铁锈最多的是_________(填字母)。
(2)用废铁皮制取铁红(Fe2O3)的部分流程示意图如下:
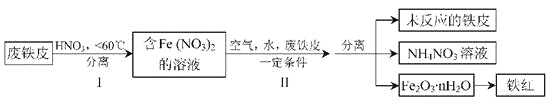
①步骤I若温度过高,将导致硝酸分解。硝酸分解的化学方程式为____________________。
②步骤Ⅱ中发生反应:4Fe(NO3)2+O2+(2n+4)H2O=2Fe2O3·nH2O+8HNO3,反应产生的HNO3又将废铁皮中的铁转化为Fe(NO3)2,该反应的化学方程式为________________________。
③上述生产流程中,能体现“绿色化学”思想的是____________________(任写一项)。
(3)已知t℃时,反应FeO(s)+CO(g)![]() Fe(s)+CO2(g)的平衡常数K=0.25。
Fe(s)+CO2(g)的平衡常数K=0.25。
①t℃时,反应达到平衡时n(CO):n(CO2)=_____________。
②若在1 L密闭容器中加入0.02 mol FeO(s),并通入xmolCO,t℃时反应达到平衡。此时FeO(s)转化率为50%,则x=___________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com