
【题目】铁及其化合物与生产、生活关系密切。
(1)下图是实验室研究海水对铁闸不同部位腐蚀情况的剖面示意图。
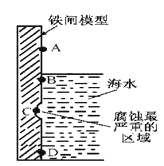
①该电化腐蚀称为__________________。
②图中A、B、C、D四个区域,生成铁锈最多的是_________(填字母)。
(2)用废铁皮制取铁红(Fe2O3)的部分流程示意图如下:
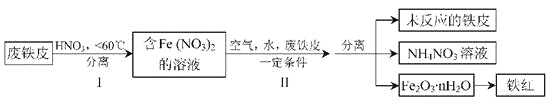
①步骤I若温度过高,将导致硝酸分解。硝酸分解的化学方程式为____________________。
②步骤Ⅱ中发生反应:4Fe(NO3)2+O2+(2n+4)H2O=2Fe2O3·nH2O+8HNO3,反应产生的HNO3又将废铁皮中的铁转化为Fe(NO3)2,该反应的化学方程式为________________________。
③上述生产流程中,能体现“绿色化学”思想的是____________________(任写一项)。
(3)已知t℃时,反应FeO(s)+CO(g)![]() Fe(s)+CO2(g)的平衡常数K=0.25。
Fe(s)+CO2(g)的平衡常数K=0.25。
①t℃时,反应达到平衡时n(CO):n(CO2)=_____________。
②若在1 L密闭容器中加入0.02 mol FeO(s),并通入xmolCO,t℃时反应达到平衡。此时FeO(s)转化率为50%,则x=___________________。
【答案】吸氧腐蚀 B 4HNO3![]() 4NO2↑+O2↑+2H2O 4Fe+10HNO3=4 Fe(NO3)2+NH4NO3+3H2O 氮氧化物排放少(或其他合理答案) 4:1 0.05
4NO2↑+O2↑+2H2O 4Fe+10HNO3=4 Fe(NO3)2+NH4NO3+3H2O 氮氧化物排放少(或其他合理答案) 4:1 0.05
【解析】
⑴①钢铁在海水(中性环境)中发生的应该是吸氧腐蚀。
②在B点的海水中氧气浓度最大,发生的吸氧腐蚀最快,生成的铁锈最多。
⑵①硝酸受热分解产生NO2、O2、H2O,通过氧化还原反应的化合价升降法将其配平。
②通过示意图分析,确定HNO3与Fe该反应的生成物除了Fe(NO3)2还有NH4NO3,先根据得失电子守恒有4Fe+10HNO3-4 Fe(NO3)2+ NH4NO3,再根据原子守恒得4Fe+10HNO3=4 Fe(NO3)2+ NH4NO3+3H2O。
③该生产流程中生成了NH4NO3,没有产生NO、NO2等有毒气体,减少了氮氧化物的排放量,符号“绿色化学”思想。
⑶①据题意有K=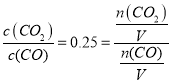 ,则n(CO):n(CO2)=4:1。
,则n(CO):n(CO2)=4:1。
②据题意有n(CO):n(CO2)=(x-0.01):0.01=4:1,解得x=0.05 mol。


科目:高中化学 来源: 题型:
【题目】人们将连有四个不同基团的碳原子形象地称为手性碳原子。曙红可用作指示剂及染料,其结构简式如图所示。下列有关曙红的说法正确的是 ( )
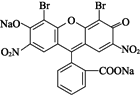
A.曙红不能与盐酸发生反应
B.1个曙红分子中含1个手性碳原子
C.1 mol曙红最多能与3 mol NaOH反应
D.曙红能发生取代、加成、消去反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工业废水中仅含下表离子中的5种:
阳离子 |
|
阴离子 |
|
某同学欲探究废水的组成,进行了如下实验:
Ⅰ![]() 取废水少许加入足量盐酸,无白色沉淀析出,但生成能使澄清石灰水变浑浊的无色无味气体
取废水少许加入足量盐酸,无白色沉淀析出,但生成能使澄清石灰水变浑浊的无色无味气体
Ⅱ![]() 向Ⅰ中所得的溶液中加入
向Ⅰ中所得的溶液中加入![]() 溶液,有白色沉淀生成.
溶液,有白色沉淀生成.
下列推断不正确的是![]()
A.溶液中一定含有的离子是![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]()
B.Ⅰ中加入盐酸生成无色气体的离子方程式是![]()
C.原溶液中的![]() 、
、![]() 、
、![]() 存在与否无法确定
存在与否无法确定
D.Ⅱ中产生白色沉淀的离子方程式是
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)写出以乙炔为原料制备![]() (聚氯乙烯)的过程中所发生的反应类型:____________、_____________。
(聚氯乙烯)的过程中所发生的反应类型:____________、_____________。![]() (聚乙烯)材料目前被公认为安全材料,也可用于制作保鲜膜和一次性餐盒。辨别
(聚乙烯)材料目前被公认为安全材料,也可用于制作保鲜膜和一次性餐盒。辨别![]() 和
和![]() 有三种方法,一是闻气味法:具有刺激性气味的是___________________;二是测密度法:密度大的应是___________________;三是燃烧法:
有三种方法,一是闻气味法:具有刺激性气味的是___________________;二是测密度法:密度大的应是___________________;三是燃烧法:![]() 的单体和
的单体和![]() 的单体在足量空气中燃烧的实验现象的明显区别是__________。
的单体在足量空气中燃烧的实验现象的明显区别是__________。
(2)![]() (
(![]() )是一种阻隔性高、韧性强、化学稳定性好的理想包装材料,广泛用于肉制品、豆制品等的包装。写出合成
)是一种阻隔性高、韧性强、化学稳定性好的理想包装材料,广泛用于肉制品、豆制品等的包装。写出合成![]() 的单体的同分异构体的结构简式_________。
的单体的同分异构体的结构简式_________。
(3) “白色污染”是指各种塑料制品对环境的污染。焚烧塑料会生成有毒物质二噁英,二噁英是含有如图所示母体的系列化合物,下列关于如图所示物质的说法不正确的是___________________(填序号)。

a.该物质在氧气中完全燃烧的产物是![]() 和
和![]()
b.该物质属于烃
c.该物质的一卤代物只有2种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于化合物2苯基丙烯(![]() ),下列说法正确的是
),下列说法正确的是
A. 不能使稀高锰酸钾溶液褪色
B. 可以发生加成聚合反应
C. 分子中所有原子共平面
D. 易溶于水及甲苯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知化学反应A2(g)+B2(g)=2AB(g)△H=+100kJ/mol的能量变化如图所示,判断下列叙述中正确的是
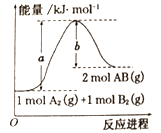
A. 加入催化剂,该反应的反应热△H将减小
B. 每生成2molA-B键,将吸收bkJ能量
C. 每生成2分子AB吸收(a-b)kJ能量
D. 该反应正反应的活化能大于100kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某华人科学家和他的团队研发出“纸电池” (如图)。这种一面镀锌、一面镀二氧化锰的超薄电池在使用印刷与压层技术后,变成一张可任意裁剪大小的“电纸”,厚度仅为0.5毫米,可以任意弯曲和裁剪。纸内的离子“流过”水和氧化锌组成电解液,电池总反应式为: Zn+2MnO2+H2O=ZnO+2MnO(OH)。下列说法正确的是

A.该电池的正极材料为锌
B.该电池反应中二氧化锰发生了氧化反应
C.电池的正极反应式为2MnO2 +2H2O+2e-= 2MnO(OH)+2OH-
D.当有0.1mol锌溶解时,流经电解液的电子数为1.204×1023
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组拟合成染料X和医药中间体Y。
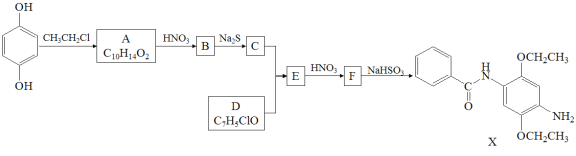
已知: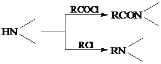 ;
;![]()
请回答:
(1)下列说法正确的是____________。
A.化合物A能与FeCl3溶液发生显色反应 B.化合物C具有弱碱性
C.化合物F能发生加成、取代、还原反应 D.X的分子式是C17H22N2O3
(2)化合物B的结构简式是___________________________________________________。
(3)写出C+D→E的化学方程式_____________________________________________________。
(4)写出化合物A(C10H14O2)同时符合下列条件的同分异构体的结构简式_____________________________。
1H-NMR谱和IR谱检测表明:①分子中有4种化学环境不同的氢原子;②分子中含有苯环、甲氧基(-OCH3),没有羟基、过氧键(-O-O-)。
(5)设计以CH2=CH2和![]() 为原料制备Y(
为原料制备Y(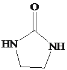 )的合成路线(用流程图表示,无机试剂任选)
)的合成路线(用流程图表示,无机试剂任选)
_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】焦亚硫酸钠(Na2S2O5)是一种常用的抗氧化剂。
某研究小组对焦亚硫酸钠进行如下研究:
(1)采用下图装置(实验前已除尽装置内的空气)制取Na2S2O5。
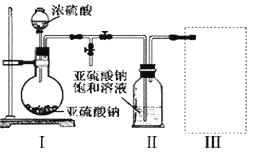
装置Ⅱ中有Na2S2O5析出,发生的化学反应方程式为:Na2SO3+ SO2= Na2S2O5。
①装置Ⅰ中产生气体的化学方程式为_____________________________。
②要从装置Ⅱ中获得已析出的晶体,可采取的分离方法是______________。
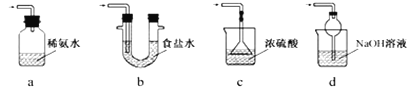
③装置Ⅲ用于处理尾气,可选用的最合理装置(夹持仪器已略去)为______(填序号)。
(2)(查阅资料)Na2S2O5溶于水即生成NaHSO3。
①NaHSO3溶液显酸性。请用化学用语和必要的文字解释原因________________________________;
证明该结论可采用的实验方法是_______________(填序号)。
a.测定溶液的pH
b.加入Ba(OH)2溶液
c.加入盐酸
d.加入品红溶液
e.用蓝色石蕊试纸检测
②检验Na2S2O5晶体在空气中已被氧化的实验方案是__________________。
(3)焦亚硫酸钠(Na2S2O5)在酸性条件下可将工业废水中的Cr2O72—还原为Cr3+。
①写出该反应的离子方程式_______________________。
②若处理Cr2O72—浓度为1×10-3mol/L的工业废水1L,需用Na2S2O5固体_________mg。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com