
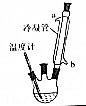
 肉桂酸乙酯具有草莓香味,用于配置香水、香精和人造精油.实验室制备肉桂酸乙酯的反应、装置示意图和有关数据如下:
肉桂酸乙酯具有草莓香味,用于配置香水、香精和人造精油.实验室制备肉桂酸乙酯的反应、装置示意图和有关数据如下: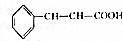 +CH3CH2OH$?_{△}^{浓硫酸}$
+CH3CH2OH$?_{△}^{浓硫酸}$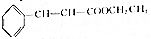 +H2O
+H2O | 相对分子质量 | 密度/(g•cm-3) | 沸点/℃ | 水中溶解性 | |
| 乙醇 | 46 | 0.789 | 78.3 | 与水互溶 |
| 肉桂酸 | 148 | 1.245 | 300 | 微溶于水 |
| 肉桂酸乙酯 | 176 | 1.049 | 270 | 不溶于水 |

分析 (1)反应混合物要回流12h,乙醇易挥发,所以需要冷凝回流;
(2)反应后得到的混合物有未反应的乙醇和肉桂酸,根据题中提供的各物质的沸点可知,可以通过蒸馏的方法去除乙醇,制备过程中需要控制温度在75℃,可以用水浴加热的方式;
(3)乙醇易挥发,加入过量的乙醇,可以提高肉桂酸的转化率;
(4)肉桂酸乙酯不溶于水,所以可以用分液的方法分离肉桂酸乙酯和水;蒸馏操作中,温度计水银球应与支管口平齐,冷却水要从下口进,据此判断;
(5)根据最终制得17.6g肉桂酸乙酯可计算出参加反应的肉桂酸的质量,肉桂酸的利用率=$\frac{参加反应的肉桂酸的质量}{起始用量}$×100%,据此计算;
解答 解:(1)反应混合物要回流12h,乙醇易挥发,需要冷凝回流,所以冷凝管的作用是冷凝回流,
故答案为:冷凝回流;
(2)反应后得到的混合物不未反应的乙醇和肉桂酸,根据题中提供的各物质的沸点可知,可以通过蒸馏的方法除去乙醇,制备过程中需要控制温度在75℃,可以用水浴加热的方式,
故答案为:除去乙醇;水浴加热;
(3)乙醇易挥发,加入过量的乙醇,可以提高肉桂酸的转化率,
故答案为:提高肉桂酸的转化率;
(4)肉桂酸乙酯不溶于水,所以可以用分液的方法分离肉桂酸乙酯和水,所用仪器为分液漏斗,蒸馏操作中,温度计水银球应与支管口平齐,冷却水要从下口进,故D装置正确,
故答案为:分液;分液漏斗;D;
(5)根据方程式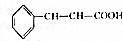 +CH3CH2OH$?_{△}^{浓硫酸}$
+CH3CH2OH$?_{△}^{浓硫酸}$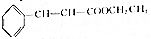 +H2O可知,制得17.6g肉桂酸乙酯,需要参加肉桂酸的质量为$\frac{148}{176}$×17.6g=14.8g,所以肉桂酸的利用率=$\frac{参加反应的肉桂酸的质量}{起始用量}$×100%=$\frac{14.8}{20}$×100%=74%,
+H2O可知,制得17.6g肉桂酸乙酯,需要参加肉桂酸的质量为$\frac{148}{176}$×17.6g=14.8g,所以肉桂酸的利用率=$\frac{参加反应的肉桂酸的质量}{起始用量}$×100%=$\frac{14.8}{20}$×100%=74%,
故答案为:74%;
点评 本题为考查了有机实验方案的设计、混合物的分离、提纯、物质利用率的计算等知识,题目难度中等,明确实验原理是解本题关键,考查了学生的分析、理解能力及灵活应用所学知识的能力.


 金钥匙试卷系列答案
金钥匙试卷系列答案科目:高中化学 来源: 题型:选择题
| A. | Na2O2--淡黄色固体,可作漂白剂 | |
| B. | Na2O--白色固体,性质不稳定加热可生成Na2O2 | |
| C. | NaCl--用于调味,医疗上作生理盐水 | |
| D. | Na2CO3--性质稳定,可用于治疗胃酸过多 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 表面附着氨水的碳素钢在空气中主要发生析氢腐蚀 | |
| B. | 反应NH3(g)+HCl(g)?NH4Cl (s)的△H<0,△S<0 | |
| C. | 25℃时,pH=11的氨水与pH=3的盐酸等体积混合,所得溶液的pH>7 | |
| D. | 向2NH3(g)?N2(g)+3H2(g)的平衡体系中加入催化剂,NH3的平衡转化率增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学式 | CH3COOH | HA | HNO2 | H2CO3 |
| Ka | Ka=1.8×10-5 | Ka=4.9×10-10 | Ka=4.6×10-4 | Ka1=4.1×10-7 Ka2=5.6×10-11 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{2a-4b}{V}$ | B. | $\frac{2(a-b)}{V}$ | C. | $\frac{a-2b}{V}$ | D. | $\frac{2a-b}{V}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com