
【题目】下列图象正确的是( )
A. 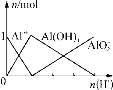 B.
B. 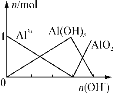
C. 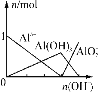 D.
D. 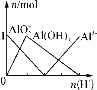
【答案】B
【解析】根据图像中横纵坐标轴所代表的溶液成分,分析将一种溶液滴加到另一种溶液,所发生的反应与图像变化是否一致,以此解答。
A.图像A为向可溶性铝盐溶液中加强酸,不发生反应,故A错误;
B. 图像B为向可溶性铝盐溶液中加强碱溶液,先发生Al3++3OH-=Al(OH)3↓,继续加碱,氢氧化铝溶解,Al(OH)3+OH-=AlO2-+2H2O,两步反应耗碱量为3:1,且当沉淀量达到最大时,Al3+浓度为0,故B正确;
C. 图像C为向可溶性铝盐溶液中加强碱溶液,但从图像看生成的氢氧化铝最大的物质的量小于开始时Al3+的物质的量,即铝元素不守恒,故C错误;
D. 图像D为向偏铝盐溶液中加强酸溶液,先发生AlO![]() +H++H2O===Al(OH)3↓,生成氢氧化铝沉淀,后发生Al(OH)3+3H+ =Al3++3H2O,沉淀溶解,当沉淀量达到最大时,AlO
+H++H2O===Al(OH)3↓,生成氢氧化铝沉淀,后发生Al(OH)3+3H+ =Al3++3H2O,沉淀溶解,当沉淀量达到最大时,AlO![]() 浓度不为0,故D错误;
浓度不为0,故D错误;
故答案选B。


 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案科目:高中化学 来源: 题型:
【题目】已知H2(g)+2ICl(g)![]() I2(g)+2HCl(g),该反应分①、②两步进行,其能量曲线如图所示,
I2(g)+2HCl(g),该反应分①、②两步进行,其能量曲线如图所示,
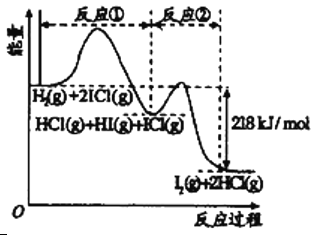
下列有关说法正确的是
A. 反应①为吸热反应
B. 反应①和②均是同种元素间发生的氧化还原反应
C. 反应①比反应②的速率慢,与图中相应峰高有关
D. HI(g)+ICl(g) ![]() I2(g)+HCl(g)生成1摩尔HCl放出218kJ的热量
I2(g)+HCl(g)生成1摩尔HCl放出218kJ的热量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“碳捕捉技术”是指通过一定的方法将工业上产生的CO2分离出来并利用。如可利用NaOH溶液来“捕捉CO2”,其基本过程如图所示(部分条件及物质未标出)
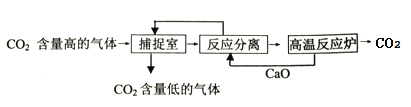
下列有关该方法的叙述中正确的是
A. 能耗小是该方法的一大优点
B. 整个过程中,只有一种物质可以循环利用
C. “反应分离”环节中,分离物质的基本操作是过滤、蒸发、结晶
D. 该方法可减少碳排放,捕捉到的CO2还可用来制备甲醇等产品
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】FeCl3是一种常用的净水剂,化学研究两小组甲、乙分别用如图装置制备无水FeCl3并证明产品中没有FeCl2,已知无水FeCl3在空气中易潮解,加热易升华。
I.小组甲拟用下图实验装置来制备无水FeCl3。(每个虚线框表示一个单元装置)

(1)请用文字描述方法改正以上装管的错误_____________。
II.小组乙用下列装置组装制备无水FeCl3的装置:

(2)A中发生反应的离子方程式为_______________。
(3)装置接口的连接顺序为__________(用a、b、c……i表示):反应开始前应先点燃____处酒精灯(填“A”或“C”)。
(4)装置B的作用_________________。
(5)如果拆去E和F装置,可能的后果是___________。
(6)证明产品中没有FeCl2的操作____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用如图所示的装置蒸馏海水,下列说法正确的是( )

A. 实验时冷却水应从a进入,从b流出
B. 蒸馏烧瓶中要加入碎瓷片,目的是防止暴沸
C. 锥形瓶中能收集到高浓度的氯化钠溶液
D. 该装置可用于分离海水中的NaCl和MgCl2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的数值,下列说法错误的是
A. 7gCnH2n中含有NA个碳氢共价键
B. 标准状况下,22.4LCHCl3中含有3NA个氯原子
C. 含0.3molNH4NO3与amolNH3·H2O的中性溶液中含0.3NA个NH4+
D. 1molNa与O2反应生成Na2O和Na2O2的混合物的过程中失去NA个电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数值。下列有关叙述正确的是( )
A. 27 g铝中加入1 mol·L-1的NaOH溶液,转移电子数是3NA
B. 标准状况下,33.6 L HF中含有氟原子的数目为1.5NA
C. 6.4 g由S2、S4、S8组成的混合物含硫原子数为0.2NA
D. 25 ℃,pH=7的NH4Cl和NH3·H2O的混合溶液中,含OH-的数目为10-7NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于氨的叙述中,错误的是( )
A.氨易液化,因此可用作制冷剂
B.氨易溶解于水,因此可用来做喷泉实验
C.氨极易溶解于水,因此氨水比较稳定(很难分解)
D.氨溶解于水显弱碱性,因此可使酚酞试剂变为红色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(题文)根据物质结构有关性质和特点,回答以下问题:
(1)过渡元素Co 基态原子价电子轨道表达式为_______________________________。第四电离能I4 (Co) < I4 (Fe) ,其原因是__________________________________________。
(2)磷的氯化物有两种:PCl3和PCl5 ,PCl3中磷原子的杂化类型为__________,PCl3的立体构型为__________,其中PCl3的沸点________(填“大于”或“小于”)PCl5,原因是__________。
(3)酞菁铟是有机分子酞菁与金属铟形成的复杂分子,结构简式如下图所示,该分子中存在的化学键为___________(填选项字母)
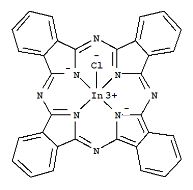
a.σ键 b.π键 c.离子键 d.配位键
(4)氯有多种含氧酸,其电离平衡常数如下:
化学式 | HClO4 | HClO3 | HClO2 | HClO |
Ka | 1×1010 | 1×10 | 1×102 | 4×108 |
从物质结构的角度解释以上含氧酸 Ka 依次减小的原因________________________。
(5)钴的一种化合物的晶胞结构如下图所示:
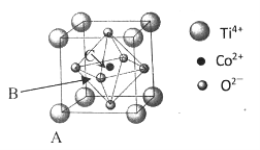
①已知A点的原子坐标参数为(0,0,0),C 点为(1/2,1/2,1/2),则B点的原子坐标参数为___________。
②已知晶胞参数 a = 0.5485 nm,则该晶体的密度为_______________g/cm3。(列出计算表达式即可)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com