
����Ŀ�������ģ��������ʽṹ�й����ʺ��ص㣬�ش��������⣺
��1������Ԫ��Co ��̬ԭ�Ӽ۵��ӹ������ʽΪ_______________________________�����ĵ�����I4 (Co) < I4 (Fe) ����ԭ����__________________________________________��
��2�����Ȼ��������֣�PCl3��PCl5 ��PCl3����ԭ�ӵ��ӻ�����Ϊ__________��PCl3�����幹��Ϊ__________������PCl3�ķе�________������ڡ���С�ڡ���PCl5��ԭ����__________��
��3��̪ݼ�����л�����̪ݼ��������γɵĸ��ӷ��ӣ��ṹ��ʽ����ͼ��ʾ���÷����д��ڵĻ�ѧ��Ϊ___________����ѡ����ĸ��
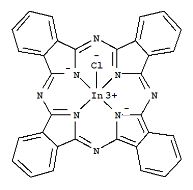
a���Ҽ� b���м� c�����Ӽ� d����λ��
��4�����ж��ֺ����ᣬ�����ƽ�ⳣ�����£�
��ѧʽ | HClO4 | HClO3 | HClO2 | HClO |
Ka | 1��1010 | 1��10 | 1��102 | 4��108 |
�����ʽṹ�ĽǶȽ������Ϻ����� Ka ���μ�С��ԭ��________________________��
��5���ܵ�һ�ֻ�����ľ����ṹ����ͼ��ʾ��
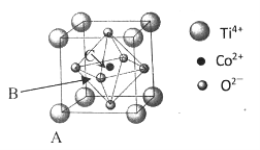
����֪A���ԭ���������Ϊ��0��0��0����C ��Ϊ��1/2��1/2��1/2������B���ԭ���������Ϊ___________��
����֪�������� a = 0.5485 nm����þ�����ܶ�Ϊ_______________g/cm3�����г��������ʽ���ɣ�
���𰸡�3d74S2���Ų�ͼ��ʧȥ���ǽ��ȶ���3d5�е�һ�����ӣ�Coʧȥ����3d6�е�һ������sp3������С�����Ȼ������Ȼ�����Һ̬ʱ�����ɷ�����ɵ����ʣ��������Ȼ��ķ��Ӽ��������ϴ����Ȼ��ķе�ϸ�abd���ǻ����������μ�С������ԭ�Ӽ�̬���μ�С��1/2,0,1/2 ��![]()
��������
(1)����Ԫ��Co Ϊ27��Ԫ�أ���̬ԭ�Ӽ۵��ӹ������ʽΪ3d74S2����һ����ʧȥ3�����ӣ�����ʧȥ���ȶ���3d5�е�һ�����ӣ�����Ҫ�ܴ����������Coʧȥ����3d6�е�һ�����ӣ����Ե�����ҪСЩ�������ĵ��ĵ����ܴ����ܵĵ��ĵ����ܡ�(2)���Ȼ�������ԭ�ӵļ۲���Ӷ���Ϊ3+��5-3��1��/2=4���ӻ���ʽΪsp3���ռ乹��Ϊ�����Ρ����Ȼ������Ȼ�����Һ̬ʱ�����ɷ�����ɵ����ʣ��������Ȼ��ķ��Ӽ��������ϴ����Ȼ��ķе�ϸߡ� (3) �л�����̪ݼ��������γɵĸ��ӷ����У������д���̼̼֮��Ķ��صĻ�ѧ�������ЦҼ��ͦм��������е�ԭ�Ӻͽ�����֮���γ���λ������ѡabd�� (4) HClO4 ��HClO3 ��HClO2��HClO������һ���ǻ�������ǻ�����ԭ�Ӹ����ֱ�Ϊ3��2��1��0�����ݵ���ƽ�ⳣ������ԭ�Ӹ����Ĺ�ϵ���������ǻ�������Խ�٣�����ƽ�ⳣ��ԽС�����������Ԫ����Ԫ�صĻ��ϼۣ��ֱ�Ϊ+7��+5��+3��+1������ԭ�Ӽ�̬ԽС������ƽ�ⳣ��ԽС������ԭ�Ӽ�̬���μ�С �� (5) ����֪A���ԭ���������Ϊ��0��0��0����C ��Ϊ��1/2��1/2��1/2����B��C���Ϊ���ģ���B����x��zϵ������C����ͬ��yϵ������Ϊ0����B���ԭ���������Ϊ��1/2,0,1/2 ��������������Ϊa=0.5485nm�������Ϊ��0.5485��10-7cm��3��Tiλ�ڶ��㣬����Ϊ8��1/8=1��Oλ�����ģ�����Ϊ6��1/2=3��Coλ�����ģ�����Ϊ1����ѧʽΪTiCoO3���þ�����ܶ�Ϊ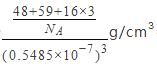 =
=![]() ��
��


 ��ѧ����ͬ����ϰϵ�д�
��ѧ����ͬ����ϰϵ�д� ��ǰ�κ�ͬ����ϰϵ�д�
��ǰ�κ�ͬ����ϰϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����100 mL NaOH��Һ��ͨ��һ������CO2���壬��ַ�Ӧ������������Һ����μ���0.2 mol/L�����ᣬ����CO2������������������֮���ϵ����ͼ��ʾ�������ж���ȷ���ǣ� ��

A. ԭNaOH��Һ��Ũ��Ϊ0.1 mol��L��1
B. ͨ��CO2�����Ϊ448 mL
C. ������Һ�����ʳɷֵ����ʵ���֮��Ϊn(NaOH)��n(Na2CO3)��1��3
D. ������Һ�����ʳɷֵ����ʵ���֮��Ϊn(NaHCO3)��n(Na2CO3) �� 2��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����50mL0.50mol/L������50mL0.55mol/LNaOH��Һ����ͼ��ʾ��װ���н����кͷ�Ӧ��ͨ���ⶨ��Ӧ���������ų��������ɼ����к��ȡ��ش��������⣺
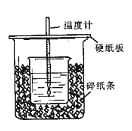
��1����ʵ��װ���Ͽ���ͼ����ȱ�ٵ�һ�ֲ��������� ��
��2���ձ���������ֽ���������� ��
��3�����ձ����粻��Ӳֽ�壬��õ��к�����ֵ (����ƫ��ƫС����Ӱ����)
��4�������60mL0.50mol/L������50mL0.55mol/LNaOH��Һ���з�Ӧ��������ʵ����ȣ����ų������� (������ȡ��������)�������к��� (������ȡ��������)����������
��5������ͬŨ�Ⱥ�����İ�ˮ(NH3��H2O)����NaOH��Һ��������ʵ�飬��õ��к��ȵ���ֵ�� ��������ƫ��������ƫС��������Ӱ��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и�������һ���ܴ���������ǣ� ����
A. ��ǿ����Һ�У�Na+��K+��AlO2����CO32��
B. ��pH=0����Һ�У�K+��Fe2+��Cl����NO3��
C. �ں�����Fe3+����Һ�У�NH4+��Na+��Cl����SCN��
D. ��c��H+��=10��13mol/L����Һ�У�NH4+��Al3+��SO42����NO3��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������Ϣ�ж�����ȼ������ˮʱ�������仯������һ����ȷ����(����)

A. H2O�ֽ�ΪH2��O2ʱ�ų�����
B. ����1mol H2Oʱ��������245 kJ
C. �ס��ҡ��������������е���������С��ϵΪ��>��>��
D. ������������������С��ˮ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һС����Ͷ�뵽ʢ���Ȼ�þ��Һ���Թ�������ܹ۲쵽�������� (����)
A.�۳�С����Һ�����ζ�
B.����������
C.��Һ�ײ�������ɫ��������
D.��Һ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������Ӧ��ԭ���ԭ�������˶��ֵ�������㲻ͬ����Ҫ����ط�����Խ��Խ��Ҫ�����ã���������ɴ����������ǡ����ԡ�������ȣ����벻����ʽ�����ĵ�أ�ͬʱ�����ĵ����㶪��Ҳ��Ի��������Ⱦ������������ṩ����Ϣ���ش��������⣺
��1���о���Ա���������һ�֡�ˮ����أ����ֵ�������õ�ˮ�뺣ˮ֮�京�����IJ����з��磬�ں�ˮ�е�ط�Ӧ�ɱ�ʾΪ��5MnO2 +2Ag+2NaCl=Na2Mn5O10 +2AgCl��
�ٸõ�صĸ�����Ӧʽ��______________��
���ڵ���У�Na + �����ƶ�����ˮ����ص�_______�����������������
�����·ÿͨ��4mol����ʱ������Na2 Mn5 O10 �����ʵ�����_______��
��2���й���ѧԺӦ�û�ѧ�о����ڼ��飨CH4��һ�ֿ�ȼ�ȼ�ϵ�ؼ�����������ͻ�ơ�����ȼ�ϵ�صĹ���ԭ������ͼ��ʾ��
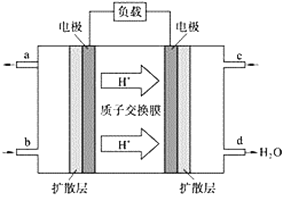
�ٸõ�ع���ʱ��b��ͨ�������Ϊ____________��
�ڸõ�ظ����ĵ缫��Ӧʽ_________________________��
�۹���һ��ʱ���3.2 g������ȫ��Ӧ����CO2ʱ����__________NA������ת�ơ�
��3��Ag2O����п���Ե�ص������������ʣ�����п���Ե�صĵ������ҺΪKOH��Һʱ����طŵ�ʱ������Ag2Oת��ΪAg��������Znת��ΪZn(OH)2��д���õ�ط�Ӧ����ʽ��__________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������˻��������й���ͳ���Ʒ��ź�ֽ����Ϊ���⣬�����Ͻ��Ƴɣ�ʹ�õ�ȼ��Ϊ���顣����˵������ȷ����
A.������ȫȼ�յIJ����Ƕ�����̼��ˮ
B.���ȼ���ñ������ú������
C.������һ�����ܵ�����Ĥ�ɷ�ֹ�丯ʴ
D.�����ȼ�������ȷ�Ӧ
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com