
短周期元素R、Q、M、T在元素周期表中的相对位置如下表,已知R原子最外层电子数与次外层电子数之比为2:1。

(1)人的汗液中台有T的简单离子,其离子结构示意图为_________________;元素M在元素周期表中的位置是___________________。
(2)R的最高价氧化物所含的化学键类型是__________键(选填“离子”或“共价”)。
(3)加热时,Q的最高价氧化物对应水化物的浓溶液与单质R反应的化学方程式为__________(用具体的化学式表示)。
(4)在一定条件下甲、乙、丙有如下转化:甲 乙
乙 丙,若其中甲是单质,乙、丙为化合物,x是具有氧化性的无色气体单质,则甲的化学组成不可能是________(选填序号,下同)。
丙,若其中甲是单质,乙、丙为化合物,x是具有氧化性的无色气体单质,则甲的化学组成不可能是________(选填序号,下同)。
①R???? ②Q2?? ③M???? ④T2
(5)工业上,常利用。RO与MO2反应生成固态M单质和RO2,从而消除这两种气体对大气的污染。
已知:2RO(g)+O2(g)=2RO2(g)? △H=-akJ·mol-l
M(s)+O2(g)=MO2(g)????? △H=-bkJ·mol-l
则反应2RO(g)+MO2(g)=2RO2(g)+M(s)?? △H=___________。
(6)元素T的含氧酸HTO具有漂白性。往20mL 0.0lmol·L-l的HTO溶液中逐滴加入一定浓度的烧碱溶液,测得混合溶液的温度变化如下图所示。据此判断:该烧碱溶液的浓度为______________mol·L-l;下列有关说法正确的是_______________。

①HTO的电离常数:b点>a点
②由水电离出的c(OH—):b点<c点
③从a点到b点,混合溶液中可能存在:c(TO—)= c(Na+)
④从b点到c点,混合溶液中一直存在:c(Na+)>c(TO-)>c(OH-)>c(H+)
(1)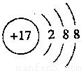 ;第三周期第ⅥA族? (2)共价
;第三周期第ⅥA族? (2)共价
(3)4HNO3(浓)+C 4NO2↑+CO2↑+2H2O? (4)④
4NO2↑+CO2↑+2H2O? (4)④
(5)2CO(g)+SO2(g)=2CO2(g)+S(s)?? △H=-(a-b)kJ/mol
(6)0.01;①③(漏选扣1分,错选不得分)
【解析】
试题分析:根据短周期元素R、Q、M、T在元素周期表中的相对位置可知,R、Q是第二周期元素,M、T是第三周期元素。已知R原子最外层电子数与次外层电子数之比为2:1,则R是碳元素,因此Q是氮元素,M是硫元素,T是氯元素。
(1)氯离子的核外电子数是18个,其离子结构示意图为 ;硫元素的原子序数是16,在元素周期表中的位置是第三周期第ⅥA族。
;硫元素的原子序数是16,在元素周期表中的位置是第三周期第ⅥA族。
(2)R的最高价氧化物是CO2,所含的化学键类型是共价键。
(3)加热时,Q的最高价氧化物对应水化物的浓溶液即浓硝酸与单质碳反应的化学方程式为4HNO3(浓)+C 4NO2↑+CO2↑+2H2O。
4NO2↑+CO2↑+2H2O。
(4)在一定条件下甲、乙、丙有如下转化:甲 乙
乙 丙,若其中甲是单质,乙、丙为化合物,x是具有氧化性的无色气体单质,则x应该是氧气,所以甲可能是碳、硫或氮气,所以氯气是不可能的,答案选④。
丙,若其中甲是单质,乙、丙为化合物,x是具有氧化性的无色气体单质,则x应该是氧气,所以甲可能是碳、硫或氮气,所以氯气是不可能的,答案选④。
(5)已知:①2CO(g)+O2(g)=2CO2(g) △H=-akJ·mol-l,②S(s)+O2(g)=SO2(g)? △H=-bkJ·mol-l,
则根据盖斯定律可知①-②即得到反应2CO(g)+SO2(g)=2CO2(g)+S(s),所以该反应的反应热△H=-(a-b)kJ/mol。
(6)二者恰好反应时放出的热量最多,所以根据图像可知恰好反应时消耗氢氧化钠溶液的体积是20ml,因此根据反应的方程式HClO+NaOH=NaClO+H2O可知,氢氧化钠溶液的浓度是(0.020L×0.0lmol·L-l)÷0.02L=0.01mol/L;根据图像可知b点溶液温度高,次氯酸的电离是吸热的,因此升高温度促进电离,则电离常数是b点>a点,①正确;b点恰好反应生成的次氯酸钠水解促进水的电离。c点氢氧化钠过量,抑制水的电离,则由水电离出的c(OH—):b点>c点,②不正确;从a点到b点,混合溶液可能显中性,则根据电荷守恒可知,溶液中可能存在:c(TO—)= c(Na+),③正确;从b点到c点,混合溶液中不一定一直存在:c(Na+)>c(TO-)>c(OH-)>c(H+),当氢氧化钠的物质的量浓度较大时,也可能出现c(Na+) >c(OH-)>c(TO-)>c(H+),④能正确,答案选①③。
考点:考查元素周期表的结构、化学键、氧化还原反应方程式书写、物质推断、盖斯定律的应用以及酸碱中和反应、溶液中离子浓度大小比较等


科目:高中化学 来源: 题型:
| 元素代号 | W | R | X | Y | Z | Q | M |
| 原子半径/nm | 0.037 | 0.186 | 0.074 | 0.075 | 0.077 | 0.110 | 0.160 |
| 主要化合价 | +1 | +1 | -2 | -3,+5 | +2、+4 | -3、+5 | +2 |
| ||
| ||


查看答案和解析>>
科目:高中化学 来源: 题型:
(2008?闵行区模拟)几种短周期元素的部分性质的数据见下表:
|
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
根据下表中部分短周期元素的原子半径及主要化合价信息,
|
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com