
【题目】下列实验仪器不宜直接用来加热的是( )
A. 试管 B. 坩埚 C. 蒸发皿 D. 烧杯
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】下列说法中错误的是( )
A. 温度越高,酶的催化活性越强
B. 浓硝酸使皮肤呈黄色是由于浓硝酸与蛋白质发生了颜色反应
C. 用灼烧的方法可以鉴别毛织物和棉织物
D. 在豆浆中加入少量的石膏,能使豆浆凝结为豆腐
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
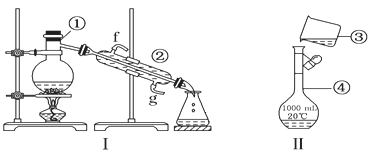
(1)写出下列仪器的名称:
①___________;②___________;④___________;
(2)仪器①~④中,使用时必须检查是否漏水的有___________(填序号)
(3)若利用装置Ⅰ分离酒精和水的混合物,还缺少的仪器有___________,将仪器补充完整后进行的实验操作的名称为___________;②的进水口是___________(填f或g)
(4)现需配制250ml 0.2mol/L NaCl溶液,装置Ⅱ是某同学转移溶液的示意图,指出图中的错误操作___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】主族元素W、X、Y、Z的原子序数依次增大,W的原子最外层电子数是次外层电子数的3倍。X、Y和Z分属不同的周期,它们的原子序数之和是W原子序数的5倍。在由元素W、X、Y、Z组成的所有可能的二组分化合物中,由元素W与Y形成的化合物M的熔点最高。请回答下列问题:
(1)W元素原子的L层电子排布式为___________ ,W3分子的空间结构为___________;
(2)X单质与水发生主要反应的方程为___________;
(3)化合物M的化学式为___________,其晶体结构与NaCl相同,而熔点高于NaCl.M熔点较高的原因是___________,将一定量的化合物ZX负载在M上可制得ZX/M催化剂,用于催化碳酸二甲酯与月桂醇酯交换合成碳酸二月桂酯.在碳酸二甲酯分子中,碳原子采用的杂化方式有___________ ,O-C-O的键角约为___________;
(4)X、Y、Z可形成立方晶体结构的化合物,其晶胞中X占据所有棱的中心,Y位于顶角,Z处于体心位置,则该晶体的组成X:Y:Z= ___________;
(5)许多金属盐都可以发生焰色反应,其原因是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铬是人体必需的微量元素,但铬过量会引起污染,危害人体健康。不同价态的铬毒性不一样,六价铬的毒性最大。下列叙述错误的是( )
A.K2Cr2O7可以氧化乙醇,可用来鉴别司机是否酒后驾驶
B.污水中铬一般以Cr3+存在,与水中的溶解氧作用可被还原为六价铬
C.人体内六价铬超标,服用维生素C缓解毒性,说明维生素C具有还原性
D.1 mol ![]() 得到6 mol电子时,还原产物是Cr3+
得到6 mol电子时,还原产物是Cr3+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组欲测定室温下(25℃、101kPa)的气体摩尔体积。该小组设计的简单实验装置如图所示:
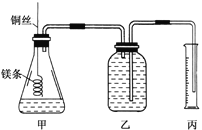
该实验的主要操作步骤如下:
①配制质量分数为36.5%的盐酸(假设其密度为1g/cm3);
②量取10.0mL该盐酸溶液加入锥形瓶中;
③称取a g已除去表面氧化膜的镁条,并系于铜丝末端,为使HCl全部参加反应,a的数值至少为___________;
④往广口瓶中装入足量水,按如图连接好装置,检查装置的气密性;
⑤反应结束后待体系温度恢复到室温,读出量筒中水的体积为V mL。
请回答下列问题.
(1)题中涉及反应的化学方程式为___________。
(2)实验步骤⑤中应选用___________(填序号)的量筒.
A.1000mL B.2000mL C.5000mL
读数时除恢复到室温外,还要注意___________;
(3)若忽略水蒸气的影响,在实验条件下测得气体摩尔体积的计算式为Vm= ___________,若未除去镁条表面的氧化膜,则测量结果___________(填“偏大”、“偏小”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子一定能在指定溶液中大量共存的是( )
A.使酚酞变红色的溶液中:Na+、Al3+、SO42-、Cl-
B.![]() =1×10-13 mol·L-1的溶液中:NH4+、Ca2+、Cl-、NO3-
=1×10-13 mol·L-1的溶液中:NH4+、Ca2+、Cl-、NO3-
C.与Al反应能放出H2的溶液中:Fe2+、K+、NO3-、SO42-
D.水电离的c(H+)=1×10-13 mol·L-1的溶液中:K+、Na+、AlO2-、CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 ⑴已知碳酸二级电离较偏铝酸的电离容易,而石炭酸的电离介于碳酸的一级电离与二级电离之间。下面的推论正确的是_________________:
①将CO2通入偏铝酸钠溶液中,溶液变浑浊,并生成碳酸钠或碳酸氢钠;②将CO2通入C6H5ONa溶液中,离子反应式为CO2+H2O+2C6H5O—![]() 2 C6H5OH+CO32—;
2 C6H5OH+CO32—;
③HCO3—在溶液中既能与AlO2—又能与Al3+反应,且都发生双水解;④往含有大量CO32—的溶液中加入C6H5OH得到澄清溶液,放出CO2气体;⑤向Al(OH)3的混浊液中加入Na2CO3溶液得不到澄清溶液;⑥相同温度,相同浓度的Na2CO3、C6H5ONa、NaHCO3、NaAlO2的稀溶液PH依次增大。
(2)浅绿色的Fe(NO3)2溶液中,存在如下平衡:Fe2++2H2O![]() Fe(OH) 2+2H+若在此溶液中加入盐酸后,用文字说明溶液颜色的变化及原因__________________.
Fe(OH) 2+2H+若在此溶液中加入盐酸后,用文字说明溶液颜色的变化及原因__________________.
⑶一个完整的氧化还原反应方程式可以拆开,写成两个“半反应式”,一个是“氧化反应式”,一个是“还原反应式”。如2Fe3++Cu=2Fe2++Cu2+,可拆写为氧化反应式:Cu-2e-=Cu2+,还原反应式:2Fe3++2e-=2Fe2+。据此,回答下列问题:
①将反应3 Cu+8H+ +2NO3-=3Cu2++2NO↑+4H2O拆写为两个“半反应式”:
还原反应式: 。
②已知某反应的两个“半反应式”为:
CH4+10 OH--8e-=CO32-+7H2O, O2+2H2O+4e-= 4OH-,
则氧化还原反应方程式为 。
③此原理可用于电化学。锌—锰碱性电池广泛应用于日常生活。电池的总反应式为Zn(s)+2MnO2(s)+2H2O(l)===Zn(OH)2(s)+2MnOOH(s)。
该电池的正极反应式为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com