
【题目】 ⑴已知碳酸二级电离较偏铝酸的电离容易,而石炭酸的电离介于碳酸的一级电离与二级电离之间。下面的推论正确的是_________________:
①将CO2通入偏铝酸钠溶液中,溶液变浑浊,并生成碳酸钠或碳酸氢钠;②将CO2通入C6H5ONa溶液中,离子反应式为CO2+H2O+2C6H5O—![]() 2 C6H5OH+CO32—;
2 C6H5OH+CO32—;
③HCO3—在溶液中既能与AlO2—又能与Al3+反应,且都发生双水解;④往含有大量CO32—的溶液中加入C6H5OH得到澄清溶液,放出CO2气体;⑤向Al(OH)3的混浊液中加入Na2CO3溶液得不到澄清溶液;⑥相同温度,相同浓度的Na2CO3、C6H5ONa、NaHCO3、NaAlO2的稀溶液PH依次增大。
(2)浅绿色的Fe(NO3)2溶液中,存在如下平衡:Fe2++2H2O![]() Fe(OH) 2+2H+若在此溶液中加入盐酸后,用文字说明溶液颜色的变化及原因__________________.
Fe(OH) 2+2H+若在此溶液中加入盐酸后,用文字说明溶液颜色的变化及原因__________________.
⑶一个完整的氧化还原反应方程式可以拆开,写成两个“半反应式”,一个是“氧化反应式”,一个是“还原反应式”。如2Fe3++Cu=2Fe2++Cu2+,可拆写为氧化反应式:Cu-2e-=Cu2+,还原反应式:2Fe3++2e-=2Fe2+。据此,回答下列问题:
①将反应3 Cu+8H+ +2NO3-=3Cu2++2NO↑+4H2O拆写为两个“半反应式”:
还原反应式: 。
②已知某反应的两个“半反应式”为:
CH4+10 OH--8e-=CO32-+7H2O, O2+2H2O+4e-= 4OH-,
则氧化还原反应方程式为 。
③此原理可用于电化学。锌—锰碱性电池广泛应用于日常生活。电池的总反应式为Zn(s)+2MnO2(s)+2H2O(l)===Zn(OH)2(s)+2MnOOH(s)。
该电池的正极反应式为 。
【答案】
(1)①⑤;
(2)溶液有浅绿色变为棕黄色,Fe2+被(H+和NO3-的组合)氧化为Fe3+
(3)①8H+ +2NO3-+6e-=2NO↑+4H2O
②CH4+2OH-+2O2-=CO32-+3H2O
③2MnO2+2H2O+2e- == 2MnOOH+2OH-
【解析】
试题分析:⑴已知碳酸二级电离较偏铝酸的电离容易,而石炭酸的电离介于碳酸的一级电离与二级电离之间,表示酸性:碳酸>石炭酸>碳酸氢根离子>偏铝酸。①因为酸性碳酸>碳酸氢根离子>偏铝酸,将CO2通入偏铝酸钠溶液中,溶液变浑浊,并生成碳酸钠或碳酸氢钠,正确;②因为酸性石炭酸>碳酸氢根离子将CO2通入C6H5ONa溶液中,离子反应式为CO2+H2O+C6H5O—→2C6H5OH+HCO3—,错误;③HCO3—在溶液中能与AlO2—反应属于强酸制弱酸,与Al3+发生双水解反应,错误;④因为酸性碳酸>石炭酸,往含有大量CO32—的溶液中加入C6H5OH得到澄清溶液,不能CO2气体,错误⑤因为酸性碳酸氢根离子>偏铝酸,向Al(OH)3的混浊液中加入Na2CO3溶液不发生反应,得不到澄清溶液,正确;⑥因为酸性:碳酸>石炭酸>碳酸氢根离子>偏铝酸,相同温度,相同浓度的Na2CO3、C6H5ONa、NaHCO3、NaAlO2的稀溶液,NaHCO3的pH依次最小,错误,故选①⑤;
(2)在平衡:Fe2++2H2O![]() Fe(OH) 2+2H+,加入盐酸后,H+和NO3-的组合将Fe2+氧化为Fe3+,溶液有浅绿色变为棕黄色,故答案为:溶液有浅绿色变为棕黄色,Fe2+被(H+和NO3-的组合)氧化为Fe3+;
Fe(OH) 2+2H+,加入盐酸后,H+和NO3-的组合将Fe2+氧化为Fe3+,溶液有浅绿色变为棕黄色,故答案为:溶液有浅绿色变为棕黄色,Fe2+被(H+和NO3-的组合)氧化为Fe3+;
⑶一个完整的氧化还原反应方程式可以拆开,写成两个“半反应式”,一个是“氧化反应式”,一个是“还原反应式”。如2Fe3++Cu=2Fe2++Cu2+,可拆写为氧化反应式:Cu-2e-=Cu2+,还原反应式:2Fe3++2e-=2Fe2+。据此,回答下列问题:
①反应3 Cu+8H+ +2NO3-=3Cu2++2NO↑+4H2O,其中Cu元素的化合价升高,被氧化,N元素的化合价降低,被还原,还原反应式为8H+ +2NO3-+6e-=2NO↑+4H2O,故答案为:8H+ +2NO3-+6e-=2NO↑+4H2O;
②已知某反应的两个“半反应式”为:CH4+10 OH--8e-=CO32-+7H2O……①,O2+2H2O+4e-= 4OH-……②,将①+②×2,得:CH4+2OH-+2O2-=CO32-+3H2O,故答案为:CH4+2OH-+2O2-=CO32-+3H2O;
③电池的总反应式为Zn(s)+2MnO2(s)+2H2O(l)===Zn(OH)2(s)+2MnOOH(s),其中锰元素的化合价降低,发生还原反应,该电池的正极反应式为2MnO2+2H2O+2e- == 2MnOOH+2OH-,故答案为:2MnO2+2H2O+2e- == 2MnOOH+2OH-。


 南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案科目:高中化学 来源: 题型:
【题目】水是一种重要的自然资源,是人类赖以生存不可缺少的物质.水质优劣直接影响人体健康.请回答下列问题:
(1)天然水中溶解的气体主要有___________、___________;
(2)天然水在净化处理过程中加入的混凝剂可以是___________,其纯净水作用的原理是___________;
(3)水的纯净和软化的区别是___________;
(4)硬度为1°的水是指每升水含10mgCaO或与之相当的物质(如7.1mgMgO).若某天然水中c(Ca2+)=1.2×10-3molL-1,c(Mg2+)=6×10-4molL-1,则此水的硬度为___________;
(5)若(4)中的天然水还含有c(HCO3-1)=8×10-4molL-1,现要软化10m3这种天然水,则需先加入Ca(OH)2 ___________g,后加入Na2CO3 ___________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图R、W、X、Y、Z为五种物质,若箭头表示能进一步转化的常见反应,则其中常温下能实现图示转化关系的是( )
选项 | R | W | X | Y | Z |
|
A | Si | SiO2 | H2SiO3 | NaSiO3 | SiCl4 | |
B | Na | Na2O | Na2O2 | Na2CO3 | NaOH | |
C | Fe | Fe(OH)2 | FeCl2 | FeCl3 | Fe(NO3)3 | |
D | Al | NaAlO2 | Al2(SO4)3 | AlCl3 | Al(NO3)3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 体心立方是金属最密堆积的形式
B. 在SiO2晶体中,并不存在单个“SiO2”分子
C. 干冰中,与CO2分子等距紧邻的CO2分子有8个
D. 31 g P4含有P-P键的个数为4NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能源和环境保护是世界各国关注的热点话题。请回答下列问题:
Ⅰ.目前“低碳经济”正成为科学家研究的主要课题。甲烷自热重整是一种先进的制氢方法,其反应方程式为CH4(g) +H2O (g) =CO (g) +3H2(g) 。
阅读下图,计算该反应的反应热△H=____________kJ·mol-1。
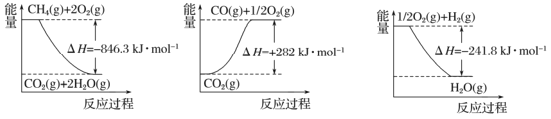
Ⅱ.收集和利用CO2是环境保护的热点课题。
500℃时,在容积为1L的密闭容器中充入1 mol CO2和3 mol H2,发生如下反应:CO2(g) +3H2 (g) ![]() CH3OH (g) +H2O (g) △H<0,测得CO2和CH3OH的浓度与时间的关系如图所示。
CH3OH (g) +H2O (g) △H<0,测得CO2和CH3OH的浓度与时间的关系如图所示。
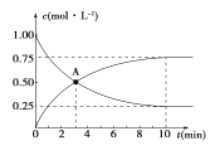
(1)0~10 min内v(H2)=_____________,
A点含义是_____________。
该反应平衡常数表达式K=____________。
(2)反应在500℃达到平衡后,改变反应温度为T,CH3OH的浓度以每分钟0.030 mol/L逐渐增大,经5 min又达到新平衡。T____________(填“>”、“<”或“=”)500℃,判断理由是___________________。
(3)温度为T时,反应达到平衡后,将反应容器的容积增大一倍。平衡向____________(填“正”或“逆”)反应方向移动,判断理由是____________。
Ⅲ.电化学法处理SO2是目前研究的热点。
利用双氧水吸收SO2可消除SO2污染,设计装置如图所示。
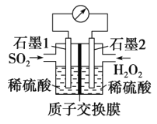
(1)石墨1为___________(填“正极”或“负极”);
正极的电极反应式为____________。
(2)若11.2 L(标准状况)SO2参与反应,则迁移H+的物质的量为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D四种元素,原子序数依次增大,A原子的最外层上有4个电子;B的阴离子和C的阳离子具有相同的电子层结构,两元素的单质反应,生成一种淡黄色的固体E,D的L层电子数等于K、M两个电子层上的电子数之和。
(1)A为 ,B为 ,C为 ,D 。(填写相应的元素名称)
(2)写出由C、D两元素组成的化合物的电子式 。
(3)A的最高价氧化物的电子式 ,C的最高价氧化物水化物的电子式 , 淡黄色的固体E的电子式 。
(4)写出A、B的化合物与E反应的化学方程式: 。
(5)写出D元素的最高价氧化物的水化物和A的单质反应的化学方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.SO2是硫酸工业尾气的主要成分。实验室中,拟用下图所示流程,测定标准状况下,体积为VL的硫酸工业尾气中SO2的含量:
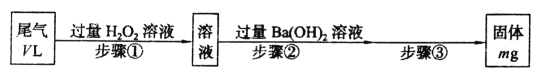
(1)步骤①中加入H2O2溶液时发生反应的离子方程式为______________________。
(2)一定温度下,BaSO4的沉淀溶解平衡曲线如图所示。步骤②逐滴加入Ba(OH)2溶液的过程中,BaSO4的溶度积常数__________(填“增大”、“减小”或“不变”),溶液中SO42-浓度的变化情况为____________(填序号)。
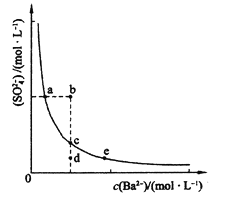
①d→c→e ②b→c→d
③a→c→e ④d→c→a
(3)该V L尾气中SO2的体积分数为________(用含有V、m的代数式表示)。
II.某烧碱样品含有少量不与酸作用的杂质,为了测定其纯度,进行以下操作:
A.在250 mL的容量瓶中准确配制250 mL烧碱溶液
B.用碱式滴定管移取25 mL烧碱溶液于锥形瓶中并滴入2滴甲基橙指示剂
C.在天平上准确称取烧碱样品m g,在烧杯中用蒸馏水溶解
D.将浓度为c mol·L-1的标准硫酸装入酸式滴定管,调整液面记下开始读数V1
E.在锥形瓶下垫一张白纸,滴定至橙色为止,记下读数V2
就此实验完成下列填空:
①正确的操作步骤的顺序是(用编号字母填写):________________。
②取碱液过程中眼睛应注视_______________________。
③滴定操作中,锥形瓶残留少量蒸馏水,则测得的结果__________(填“偏大”、“偏小”或“不变”,下同);达到滴定终点时,尖嘴处尚有一滴液滴未滴下,则测得的结果____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com