
| A、C | B、N | C、O | D、F |
科目:高中化学 来源: 题型:阅读理解
| A元素的核外电子数和电子层数相等,也是宇宙中最丰富的元素 |
| B元素原子的核外p电子数比s电子数少1 |
| C原子的第一至第四电离能分别是: I1=738kJ/mol I2=1451kJ/mol I3=7733kJ/mol I4=10540kJ/mol |
| D原子核外所有p轨道全满或半满 |
| E元素的主族序数与周期数的差为4 |
| F是前四周期中电负性最小的元素 |
| G在周期表的第七列 |


查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 元 素 | M | F | |
| 电能 (kJ?mol-1) |
I1 | 717 | 759 |
| I2 | 1509 | 1561 | |
| I3 | 3248 | 2957 | |
| 熔点/K | 沸点/K | 标准状况时在水中的溶解度 | |
| H2S | 187 | 202 | 2.6 |
| H2C2 | 272 | 423 | 以任意比互溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源:2011-2012学年贵州省湄潭中学高一下学期期中考试化学试卷 (带解析) 题型:填空题
(14分)下表是元素周期表的一部分,回答下列有关问题:
| 周期\主族 | IA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | | | | | ① | | ② | |
| 3 | ③ | ④ | ⑤ | ⑥ | | ⑦ | ⑧ | ⑨ |
| 4 | ⑩ | ? | | | | | ? | |
查看答案和解析>>
科目:高中化学 来源:2013-2014学年四川省高三“联测促改”活动理综化学试卷(解析版) 题型:填空题
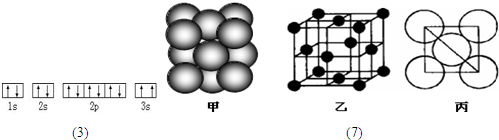
X、Y、Z、W、R.均为前四周期元素且原子序数依次增大,X的基态原子核外有7种不同运动状态的电子,Y原子最外层有2对成对电子,Z的原子序数为Y的原子序数的2倍,W3+的基态离子3d轨道为半充满状态,R的氢氧化物悬浊液可用于检验葡萄糖的存在。

请回答下列问题:
(1)X2分子中σ键和π键数目比是 。
(2)R的晶胞结构如右图所示,该晶胞中所含的原子个数是 。
(3)下列有关X、Y、W的说法正确的是 。
①X的第一电离能在同族元素中最小
②常温下,Y的氢化物分子间存在氢键
③XY3-中X的杂化轨道类型为sp3 杂化
④W属于d区的元素
(4) 将X的气态氢化物的水溶液滴入R的氢氧化物悬浊液中,可得深蓝色溶液,该反应的离子方程是 。
(5)将Na2Y2与W2+的硫酸盐按物质的量之比为1:1混合并投入水中,溶液中出现红褐色沉淀并有无色气体产生,该反应的离子方程式是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com