
【题目】实现下列变化,一定要加入其它物质作氧化剂的是
A. Zn → ZnCl2 B. Cl2→ HClO
C. CaCO3→ CO2 D. CuO → CuSO4
科目:高中化学 来源: 题型:
【题目】工业制硫酸吸收塔排出的尾气需要处理才能排放到大气中,其处理方法为:先用氨水吸收,再用浓硫酸处理,得到较高浓度的SO2和铵盐。
为测定该铵盐中氮元素的质量分数,将不同质量的铵盐分别加入到50.00mL相同浓度的NaOH溶液中,沸水浴加热至气体全部逸出(此温度下铵盐不分解)。该气体经干燥后用浓硫酸吸收完全,测定浓硫酸增加的质量。
部分测定结果:
铵盐质量为10.00g和20.00g 时,浓硫酸增加的质量相同;铵盐质量为30.00g时,浓硫酸增加的质量为0.68g;铵盐质量为40.00g时,浓硫酸的质量不变。
请计算:
(1)该铵盐中氮元素的质量分数是____%。
(2)若铵盐质量为15.00g,浓硫酸增加的质量为____。(计算结果保留两位小数)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】S2Cl2是广泛用于橡胶工业的硫化剂,常温下S2Cl2是一种橙黄色的液体,遇水易水解,并产生能使品红褪色的气体,其结构与H2O2类似。下列说法错误的是( )
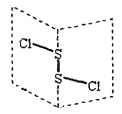
A. S2Cl2分子中的两个S原子均是sp3杂化
B. S2Cl2与H2O反应的化学方程式可能为:2S2Cl2+2H2O=SO2↑+3S↓+4HCl
C. S2Br2与S2Cl2结构相似,熔沸点S2Br2>S2Cl2
D. S2Cl2分子中的S为+1价,是含有极性键和非极性键的非极性分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组用甲、乙两套装置(如图所示)进行丙烯酸(H2C=CHCOOH)与乙醇(CH3CH2OH)酯化反应的实验。已知:乙醇的沸点为78.5℃,丙烯酸的沸点为141℃,丙烯酸乙酯的沸点为99.8℃。
回答下列问题:
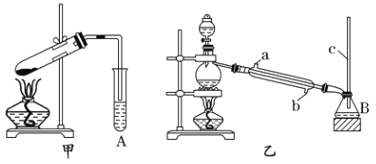
(1)仪器M的名称为_________,仪器A、B中的溶液均为 _________。
(2)甲、乙两套装置中效果比较好的装置是_______,原因是__________。
(3)乙装置中冷凝水应该从______(填“a”或“b”)口进入。
(4)若7.2g丙烯酸与5.2g乙醇完全反应,则理论上生成的丙烯酸乙酯的质量为________。(精确到小数点后一位)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式正确的是( )
A. AlCl3溶液中加入过量氨水:Al3++4NH3·H2O===AlO![]() +2H2O+4NH
+2H2O+4NH![]()
B. 硫化钠的水解反应:S2-+2H2O![]() H2S+2OH-
H2S+2OH-
C. 将等体积等物质的量浓度的NaHCO3溶液与Ba(OH)2溶液混合HCO![]() +Ba2++OH-===BaCO3↓+H2O
+Ba2++OH-===BaCO3↓+H2O
D. 单质铜与稀硝酸反应:Cu+2H++2NO![]() ===Cu2++2NO↑+H2O
===Cu2++2NO↑+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式不正确的是
A. 足量乙酸与碳酸钠溶液反应: 2 CH3COOH +CO32-→ 2CH3COO-+CO2↑+H2O
B. 醋酸溶液与新制氢氧化铜反应: 2CH3COOH+Cu(OH)2→Cu2++2CH3COO-+2H2O
C. 苯酚钠溶液中通入少量二氧化碳: 2C6H5O-+CO2+H2O→2C6H5OH+CO32-
D. 乙醛溶液与足量的银氨溶液共热CH3CHO+2[Ag(NH3)2]++2OH-![]() CH3COO-+NH4++2Ag↓+3NH3+H2O
CH3COO-+NH4++2Ag↓+3NH3+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)中国古代四大发明之一黑火药,它的爆炸反应为2KNO3+3C+S =A + N2↑ +3CO2↑(已配平)
①除S外,上述反应中所涉及到的非金属元素的电负性从大到小顺序依次为_____________,K2O,CO2,SO2,SiO2四种晶体的熔点由高到低的顺序______________________
②生成物A的电子式为_____________。推算HCN分子中![]() 键与
键与![]() 键数目之比为_______________。
键数目之比为_______________。
(2)原子序数小于36的元素Q和T,在周期表中既处于同一周期又位于同一族,且原子序数T比Q多 2。T在元素周期表中的位置为__________________,1molQ2+的未成对电子数是__________个。
(3)在![]() 的水溶液中,一定条件下存在组成为
的水溶液中,一定条件下存在组成为![]() (n和x均为正整数)的配离子,将其通过氢离子交换树脂(R-H),可发生离子交换反应:
(n和x均为正整数)的配离子,将其通过氢离子交换树脂(R-H),可发生离子交换反应:
[CrCln(H2O)6-n]x+ + xR-H = Rx[CrCln (H2O)6-n] + xH+
交换出来的H+经中和滴定,即可求出x和n,从而确定配离子的组成。
将含0.0015 mol ![]() 的溶液,与R-H完全交换后,中和交换过程中生成的H+需浓度为0.1200 mol·L-1 的NaOH溶液25.00 ml,则该配离子的化学式为_________________________。
的溶液,与R-H完全交换后,中和交换过程中生成的H+需浓度为0.1200 mol·L-1 的NaOH溶液25.00 ml,则该配离子的化学式为_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组同学利用以下装置制取并探究氨气的性质:

(1)装置A中发生反应的化学方程式为 ___________。
(2)装置B中的干燥剂是_______(填名称)。
(3)装置C中的现象是 _______。
(4)实验进行一段时间后,挤压装置D中的胶头满管,滴入1-2滴浓硫酸,可观察到的现象是_______。
(5)为防止过量氨气外逸,需要在上述装置的末端增加—个尾气吸收装置,应选用的装置是_______(填 “E"成“F"),尾气吸收过程中发生反应的化学方程式为 ________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com