
| A. | 向FeSO4和KSCN的混合溶液中滴加少量的新制氯水,溶液由浅绿色变为红色 | |
| B. | 向FeSO4溶液中滴加NaOH溶液,生成沉淀的颜色由白色迅速变为灰绿色,最后变为红褐色 | |
| C. | 向Fe(NO3)2溶液中滴加稀硫酸,能使溶液变为棕黄色 | |
| D. | 将Fe(OH)3胶体装在U形管中做电泳实验时,负(阴)极一端颜色变浅 |
分析 A.亚铁离子的溶液为浅绿色,加入新制氯水后亚铁离子被氧化成铁离子;
B.亚铁离子与氢氧化钠溶液反应生成白色沉淀氢氧化亚铁,氢氧化亚铁迅速被氧化;
C.硝酸根离子在酸性条件下能够氧化亚铁离子生成铁离子;
D.Fe(OH)3胶体吸附带正电荷.
解答 解:A.向FeSO4和KSCN的混合溶液中滴加少量的新制氯水,亚铁离子被氧化成铁离子,铁离子与硫氰根离子反应生成红色的硫氰化铁,所以溶液由浅绿色变为红色,故A正确;
B.向FeSO4溶液中滴加NaOH溶液,生成白色的氢氧化亚铁沉淀,氢氧化亚铁很快被氧化,颜色变为灰绿色,最终会变成红褐色的氢氧化铁,故B正确;
C.向Fe(NO3)2溶液中滴加稀硫酸,在酸性条件下硝酸根离子具有强氧化性,能够将亚铁离子氧化成铁离子,所以溶液变为棕黄色,故C正确;
D.Fe(OH)3胶体吸附带正电荷,将Fe(OH)3胶体装在U形管中做电泳实验时,胶体向阴极移动,则负(阴)极一端颜色变深,故D错误;
故选D.
点评 本题考查了铁离子、亚铁离子的性质及检验方法,题目难度不大,注意掌握铁离子、亚铁离子的检验方法,明确铁离子和亚铁离子、氢氧化亚铁和氢氧化铁的颜色为解答本题的关键.


 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 棕红色NO2加压后颜色先变深后变浅 | |
| B. | Fe(SCN)3溶液中加入固体KSCN后颜色变深 | |
| C. | 氯水宜保存在低温、避光条件下 | |
| D. | SO2催化氧化成SO3的反应,往往加入过量的空气 | |
| E. | 打开易拉罐有大量气泡冒出 | |
| F. | 加催化剂,使氮气和氢气在一定条件下转化为氨气 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{8}^{16}$O2和${\;}_{8}^{18}$O2互为同位素,化学性质相似 | |
| B. | C(石墨,s)=C(金刚石,s)△H>0,所以石墨比金刚石稳定 | |
| C. | 明矾和漂白粉常用于自来水的净化和杀菌消毒,两者的作用原理相同 | |
| D. | 常温下,pH=1的水溶液中Na+、NO3-、HCO3-、Fe2+可以大量共存 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
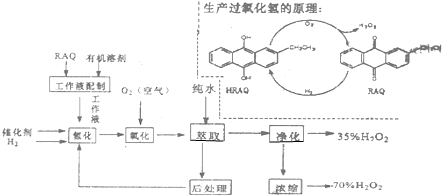
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 醇与氢卤酸反应是制备卤代烃的重要方法.实验室制备溴乙烷的装置如图所示,试管d中装有少量蒸馏水.已知溴乙烷的沸点为38.4℃,密度为1.43g/mL;可能存在的副反应有:加热反应过程中反应混合物会呈现黄色甚至红棕色;醇在浓硫酸的存在下脱水生成烯和醚等.实验步骤中:在圆底烧瓶中加入10g乙醇、足量浓硫酸,然后加入研细的20.6g溴化钠和几粒碎瓷片.
醇与氢卤酸反应是制备卤代烃的重要方法.实验室制备溴乙烷的装置如图所示,试管d中装有少量蒸馏水.已知溴乙烷的沸点为38.4℃,密度为1.43g/mL;可能存在的副反应有:加热反应过程中反应混合物会呈现黄色甚至红棕色;醇在浓硫酸的存在下脱水生成烯和醚等.实验步骤中:在圆底烧瓶中加入10g乙醇、足量浓硫酸,然后加入研细的20.6g溴化钠和几粒碎瓷片.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将胆矾加热除去结晶水后,称取16 g溶解在1 L水里 | |
| B. | 称取胆矾25 g,溶解在1 L水里 | |
| C. | 将25 g胆矾溶于水,然后将此溶液稀释至1 L | |
| D. | 将16 g胆矾溶于水,然后将此溶液稀释至1 L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com